Virología
Mecanismos de acción de compuestos antivirales aislados en plantas: el Virus de la Inmunodeficiencia Humana como modelo.
Compuestos que actúan a nivel de la replicación intracelular
Se han aislado compuestos de plantas que actúan sobre fases de la infección viral más tardías. Estas sustancias pueden inhibir etapas de la replicación posteriores a la entrada del virus en la célula hospedadora. Entre los blancos de tales compuestos se tienen las enzimas virales tales como las retrotranscriptasas y las proteasas, así como factores que intervienen en el proceso de translocación de los transcritos de RNA al citoplasma. También existen algunos de estos compuestos que pueden interferir en el proceso de integración del genoma viral.
Los inhibidores de la retrotranscriptasa viral: las cumarinas aisladas en las plantas del género Calophyllum.
Los compuestos naturales de plantas que actúan a nivel de le replicación intracelular del virus son diversos y sus blancos variados. Las cumarinas, por ejemplo, han demostrado tener una actividad anti-VIH muy específica inhibiendo efectivamente la acción de la retrotranscriptasa del VIH-1 (Pengsuparp et al, 1996; Buckheit et al, 1999). Estas moléculas no son análogos nucleosídicos, por lo que entran en la categoría de inhibidores de la retrotranscriptasa no nucleosídicos. Todas ellas comparten una estructura común de benzo-2 pirona. Existen diversas cumarinas que exhiben propiedades anti-RT del VIH-1, las cuales han sido aisladas de árboles de selvas tropicales pertenecientes al género Calophyllum. Uno de estos compuestos es el "soulattrolide", que representa el 29% de los extractos del látex de Calophyllum teysmanii (Pengsuparp et al, 1996). Estudios llevados a cabo por Pengsuparp y colaboradores (1996), mostraron una inhibición selectiva del compuesto sobre la actividad dependiente de DNA y RNA de la RT del VIH-1, mediante ensayos con la enzima incubada en presencia de timidina trifosfato marcada y de templados adecuados. Independientemente del sustrato (secuencias de poli -rA o DNA de timo de becerro), en presencia de 200 μg/mL (o 495 μM) de "soulattrolide" la actividad de la RT se inhibió en más de un 80% con relación a los controles no expuestos al compuesto (Tabla 4). Las concentraciones necesarias para inhibir en un 50% la actividad retrotranscriptasa (IC50) dependiente de DNA y RNA (Tabla 4), fueron superiores a las obtenidas con AZT (IC50= 0,051 μM), un análogo nucleosídico inhibidor de la RT, pero similares a los de otras cumarinas aisladas en Calophyllum tales como la calanolida A (IC50=0,32 μM) (Pengsuparp et al, 1996). Asimismo, Pengsuparp y colaboradores (1996) también encontraron que el compuesto era capaz de inhibir en más de 80% la actividad RNAsa de E. coli, una enzima que comparte una estructura muy similar a la RNAsa viral (Luciw, 1996).

Tabla 4. Efecto inhibitorio del "soulattrolide" sobre Polimerasas de Ácidos Nucleicos y la Ribonucleasa H.
DDDP: actividad DNA Polimerasa Dependiente de DNA; RDDP: actividad RNA Polimerasa dependiente de RNA. El compuesto se consideró inactivo cuando su porcentaje de inhibición fue cercano o inferior a 30% (Pengsuparp et al, 1996). La inhibición de la actividad de la RNAsa fue medida como la cantidad de polímeros sintéticos de RNA que no eran degradados. Para ello, se empleó una mezcla de reacción suplementada con un sustrato sintético de [3H]poli (rA).poli(dT) y ácido tricloroacético (ATC), una solución que permite precipitar los polímeros de ácidos nucleicos superiores o iguales a 20 nucleótidos (Ambion, http://www.ambion.com/techlib/misc/tcapptn.html). De tal manera, la cantidad de productos marcados precipitados obtenida en las mezclas de reacción era indicativa de la inhibición por parte del compuesto. Estos autores encontraron que la cantidad de producto marcado obtenida en mezclas expuestas a una concentración de 495 μM de "soulattrolide", fue casi 100 veces menor a la registrada en los controles sin el compuesto, sugiriendo la posibilidad de que dicha sustancia actuara sobre la RNAsa viral. El "soulattrolide" no inhibió de manera significativa la actividad dependiente de RNA de otras retrotranscriptasas virales tales como la del VIH-2, la del Virus de la Mieloblastosis Aviar y la RT mutante del VIH-1 resistente a la tiobencimidazolona (TIBO), un INNRT (Luciw, 1996). Esto reveló una acción selectiva del compuesto y sugirió la posibilidad de un solapamiento entre los sitios de unión de esta cumarina y del TIBO. El problema de muchos compuestos y medicamentos anti-VIH es que pueden llegar a ser tóxicos para los pacientes que los utilizan regularmente ya que interfieren eventualmente en procesos esenciales para el desarrollo celular. Este es el caso de la AZT, que muestra una IC50 relativamente baja para la DNA polimerasa celular β (11μ M). Para evaluar la toxicidad del "soulattrolide" se realizaron los mismos experimentos que para la RT pero con enzimas celulares tales como las DNA polimerasas α y β eucarióticas y la RNA polimerasa de E. coli. Los valores de inhibición obtenidos para la DNA polimerasa α y para la RNA polimerasa fueron inferiores al 30% en presencia de 495 μM del compuesto. Sin embargo la DNA polimerasa β resultó ser más sensible al compuesto, presentando una IC50 cercana a 495 μM. Esto podría resultar problemático si se toma en cuenta que esta enzima parece intervenir en el proceso de reparación de errores durante la replicación del DNA eucariótico (Klug y Cummings, 1999). No obstante los valores de IC50 fueron altos al compararse con los obtenidos con el AZT y con otras cumarinas como la calanolida A (205 μM). La calanolida A, así como su forma isomérica calanolida B (o costatolida) y la dihidrocalanolida A (o dihidrocostatolida), aisladas de Calophyllum lanigerum, exhibieron al igual que el "soulattrolide", la misma acción selectiva contra la RT del VIH-1 (Buckheit et al, 1999). No obstante, la propiedad más relevante de estas cumarinas fue su capacidad para inhibir sinergísticamente la citopatogenicidad del VIH-1 con una amplia gama de drogas anti-VIH, tal y como lo reveló el estudio realizado por Buckheit y colaboradores (1999). Estos investigadores midieron la viabilidad en células T infectadas con el VIH-1 en presencia de las tres cumarinas citadas anteriormente y una combinación de drogas a diferentes concentraciones. De esta forma observaron que todas las cumarinas inhibían la citopatogenicidad del virus de manera sinergística con los inhibidores nucleosídicos empleados en el ensayo, con el inhibidor no nucleosídico UC781, así como con los inhibidores de la proteasa Ritonavir y Saquinavir. El costatolide, en combinación con INRTs, mostró los mayores niveles de sinergismo entre las tres cumarinas, por lo que podría constituir la base de una terapia que permita incrementar el efecto de los INRTs. La ventaja de esta combinación es que los compuestos no compiten entre sí puesto que se unen a regiones diferentes de la retrotranscriptasa (Buckheit et al, 1999). Otra característica interesante descubierta por Buckheit y colaboradores (1999), fue que las cumarinas analizadas actuaban efectivamente sobre los virus con una mutación puntual en el residuo 181 de la retrotranscriptasa. Esta mutación consiste en el cambio de un residuo de tirosina por uno de cisteína, haciendo que el virus pierda sensibilidad hacia una serie de INNRTs.
El residuo de tirosina de la posición 181 se encuentra en un bolsillo situado en la subunidad p66 de la RT, cerca del sitio activo de la polimerasa. A este bolsillo se unen la mayoría de los INNRTs, por lo que las mutaciones que ocurren en esta región afectan la unión de estos compuestos y bloquean su efecto (Buckheit et al, 1995). Esto indica que las calanolidas A y B y la dihidrocostatolida actuaron en un sitio de unión distinto al de la mayoría de los INNRTs. Por otro lado, Buckheit y colaboradores (1999) observaron que al hacer sub-cultivos de células T infectadas con el VIH-1 en presencia de concentraciones crecientes de las tres cumarinas, se lograron aislar cepas virales resistentes a estos compuestos ya que no vieron reducida su citopatogenicidad en ensayos con XTT. Sin embargo, los virus resistentes a la calanolida A mantuvieron su sensibilidad hacia la mayoría de los INNRTs probados, así como hacia los INRTs como el AZT y el 3TC. En vista de estos resultados, hay que considerar las cumarinas como un posible complemento en los tratamientos anti-VIH, ya que actúan sinergísticamente con las drogas actualmente en uso y seleccionan virus susceptibles a otros compuestos.
Otros inhibidores de la transcriptasa reversa: el ácido repandusínico de Phyllanthus niruri.
El ácido AR, tal y como se mencionó anteriormente, es aislado de la planta Phyllantus niruri, la cual ha tenido un extenso uso medicinal. Ello motivó a un equipo de investigadores a estudiar el efecto del extracto acuoso de la planta mencionada sobre la infección por VIH-1 (Ogata et al, 1992). Para ello, Ogata y colaboradores (1992) extrajeron, en primer lugar, los componentes de la planta en agua. Después de evaporar el solvente, resuspendieron el residuo sólido en metanol generando una fracción soluble y una fracción insoluble que utilizaron para hacer ensayos de inhibición de la RT. Estos se realizaron con una RT recombinante del VIH-1 expresada en E.coli. Los investigadores incubaron la RT en un medio de reacción con timidina trifosfato marcada y secuencias de poli (rA) y oligo (dT) como templados y cebadores de la enzima, respectivamente. El DNA radioactivo sintetizado se fijó en filtros de intercambio iónico y se estimó su cantidad en un contador de centelleo. El residuo insoluble en metanol presentó la mayor actividad inhibitoria sobre la RT, por lo que Ogata y colaboradores (1992) lo sometieron a fraccionamientos sucesivos y evaluaron la actividad anti-RT de cada fracción. De esta manera se logró aislar e identificar el AR, que bloqueó de manera efectiva la actividad RT del VIH-1 mostrando valores de EC 50 inferiores a los del Foscarnet, un inhibidor específico de la RT del VIH-1. Sin embargo su actividad no fue tan selectiva como la de este último compuesto ya que también inhibió considerablemente la DNA-polimerasa eucariótica α, lo que podría explicar su efecto citotóxico a bajas concentraciones. La actividad DNA polimerasa se midió de la misma manera que para la RT, pero en el medio de reacción se agregó DNA de timo de becerro como sustrato de la enzima (Ogata et al, 1992).
Los inhibidores de la interacción REV/RRE: el Niruriside de Phyllanthus niruri.
Otro compuesto totalmente distinto a las cumarinas, es el denominado niruriside, el cual ha sido aislado de fracciones metanólicas de la misma planta de donde proviene el ácido repandusínico, Phyllanthus niruri. El niruriside actúa de modo diferente sobre el VIH-1, ya que en un estudio se observó que interfiere con la unión de Rev a RRE (Qian-Cutrone et al, 1996). Tal y como se señaló en la primera parte del trabajo, Rev es una proteína se une a los transcritos del genoma viral que contienen el elemento de respuesta a Rev (RRE). Esta interacción protege los RNAm del corte y empalme y facilita su transporte hacia el citoplasma celular. Así, para medir el efecto del niruriside sobre la formación de los complejos Rev/RRE, Qian-Cutrone et al. (1996) utilizaron una proteína Rev expresada en E.coli y un transcrito de RNA marcado con 33P que presentaba el elemento RRE. La formación de complejos entre la proteína y el RNA, se pudo monitorear y cuantificar mediante la transferencia de la proteína Rev a filtros de nitrocelulosa y la medición de la radioactividad en un medidor de centelleo: las proteínas unidas al RNA marcado mostraron actividad radioactiva, mientras que las proteínas libres no. Así, los autores observaron que, si bien el IC 50 obtenido en ensayos de XTT con células T infectadas con VIH-1 fue significativamente alto (260 μM), la cantidad de compuesto necesaria para disminuir en un 50 % la interacción de la proteína Rev con su respectivo sitio de unión en el RNA viral fue de 3,3 μM (Qian-Cutrone et al, 1996). La diferencia entre estos resultados sugiere que la acción del niruriside se ve limitada por su incapacidad para penetrar en las células.
Los inhibidores de la proteasa: los triterpenos de Geum japonicum.
La planta Geum japonicum se usa en la medicina tradicional China como un antidiurético y se sabe que contiene compuestos con actividad antiviral (Xu et al, 1996). Por tal motivo, el grupo de investigación liderado por Xu (1996), decidió separar los componentes activos de Geum japonicum partiendo de un extracto metanólico de la planta. Guiados por bioensayos, lograron determinar que la actividad antiviral del extracto venía dada por cinco triterpenos. Éstos son lípidos emparentados con los esteroides que derivan de unidades de isopreno. Xu et al. (1996) decidieron estudiar el efecto de estos compuestos sobre la proteasa de VIH-1. Para ello, incubaron la enzima en presencia de cada uno de los triterpenos en un medio con un heptapéptido sintético de secuencia aminoacídica idéntica a la del sitio de escisión de las proteínas p24-p17 del precursor Gag. La presencia de los cinco triterpenos durante la reacción inhibió la cantidad de péptido que se obtuvo en ausencia de los compuestos. Los porcentajes de inhibición variaron entre un 42% para el compuesto con menor actividad, hasta un 100 % para el triterpeno más activo (Xu et al, 1996).
Los inhibidores de la transcripción: los taninos, las calconas y las cumarinas.
La transcripción del genoma viral una vez que se ha integrado al DNA de la célula hospedadora también constituye el blanco de ciertos compuestos. Algunos actúan a nivel de proteínas que participan en la regulación de la transcripción. En efecto, ciertas proteínas de células eucariotas se encuentran unidas covalentemente a homopolímeros de poli(ADP-ribosa) que juegan un papel importante en la reparación y transcripción del DNA (Althaus, 1992). Por ejemplo, la poli-ADP-ribosilación de algunos factores de transcripción tales como la proteína de unión a TATA del complejo de la RNA polimerasa II, inhibe la transcripción genética (Oei et al, 1998).
Se sabe que los taninos de plantas como el té verde inhiben la poli(ADP-ribosa) glicohidrolasa (PARG), una enzima que participa en la despolimerización de las moléculas de poli(ADP-ribosa). Esta inhibición suprime la expresión del gen del virus del tumor mamario murino (VTMM) inducida por glucocorticoides (Tsai et al, 1992). Sobre la base de estos antecedentes, Uchiumi y colaboradores (1996) decidieron estudiar el efecto del ácido tánico sobre la transcripción de una construcción que poseía el gen reportero cloranfenicol acetil transferasa (cat) fusionado a secuencias promotoras del LTR del VIH-1 (plásmido pHIVCAT). Para observar mejor el efecto inhibitorio, estos autores sometieron ciertas células T infectadas con VIH-1 a la acción del TPA (12-O-tetradecanoilforbol-13-acetato), ya que se sabe que induce la actividad promotora de las LTR. El TPA activa proteínas quinasas que fosforilan la proteína IκB citoplasmática liberando el factor de transcripción NF-κB. Este migra al núcleo en donde se puede unir a las LTR y promover la transcripción de los genes virales (Uchiumi et al, 1996; Luciw, 1996). Los resultados obtenidos por estos autores se muestran en la Figura 8, en donde se aprecia que el ácido tánico inhibió la transcripción de CAT inducida por TPA de manera dependiente de la concentración. En las células no tratadas con TPA el efecto no se observó puesto que los niveles basales de expresión de CAT fueron muy bajos.
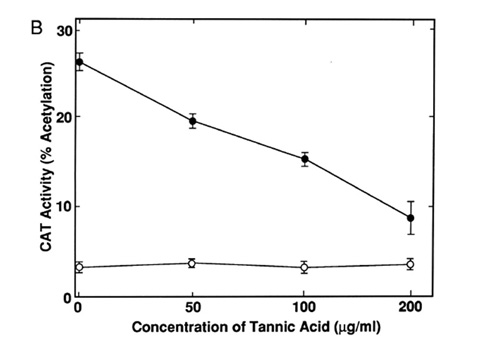
Figura 8. Efecto del ácido tánico sobre la actividad promotora del VIH inducida por TPA. Las células transfectadas con el gen cat se incubaron con o sin 50 ng/mL de TPA en presencia de diferentes concentraciones de ácido tánico. Los círculos negros representan las células tratadas con TPA mientras que los blancos representan las células no tratadas (Uchiumi et al, 1996).
Para identificar que elementos del promotor del VIH respondían al ácido tánico se construyeron plásmidos con deleciones de 318 (pHCATVII) y 358 (pHCATVIII) pares de bases en la región LTR. Los plásmidos se incorporaron a células T que se trataron con TPA en presencia o en ausencia de ácido tánico. La medición de la actividad de CAT reveló que la carencia de una secuencia nucleotídica entre las posiciones 133 y 93 anulaba la inhibición de la transcripción causada por el ácido tánico (Figura 9). Ello indicó que los elementos sensibles a la acción del ácido tánico se encontraban dentro de la región suprimida de 40 pares de bases (Uchiumi et al, 1996).
Figura 9. Determinación de los elementos de respuesta al ácido tánico. Los histogramas muestran la actividad de CAT en relación a células no tratadas con ácido tánico y transfectadas con el mismo plásmido. Las columnas grises y blancas representan las células tratadas y no tratadas con ácido tánico, respectivamente.(Uchiumi et al, 1996).
Debido a que las secuencias de unión del factor NF-κB se encontraban en dicha región, los mismos autores decidieron estudiar el efecto del ácido tánico sobre la transcripción del gen cat asociado a estas secuencias, ya que podría afectarse la expresión de otros genes. Observaron que el compuesto no inhibió la actividad de CAT, por lo que las regiones reconocidas por NF-κB no estaban involucradas en la inhibición de la transcripción mediada por el ácido tánico. De allí concluyeron que el elemento responsable del efecto inhibitorio del ácido tánico era una secuencia de 30 pares de bases que se encontraba corriente arriba de los elementos de unión a NF-κB. Esto condujo a Uchiumi y colaboradores (1996) a sugerir que el mecanismo de acción del ácido tánico en la disminución de la expresión a partir del LTR, ocurría mediante la inhibición de la acción de PARG. Se ha descrito que la poli-ADP-ribosilación de algunos factores transcripcionales conlleva a una disminución de la transcripción. La PARG se encarga de despolimerizar a dichos factores volviéndolos activos. Al parecer, en la expresión del DNA del VIH están involucrados factores asociados a ciertas regiones de las LTR que son susceptibles a la ADP ribosilación, por lo que requieren ser despolimerizados por PARG para promover la transcripción. Por lo tanto, la presencia del ácido tánico, al inhibir la PARG, impediría la despolimerización de dichos factores disminuyendo la expresión de los genes virales. Motivados por esta investigación y por otros trabajos que mostraban que los ligninos también inhibían la PARG, Uchiumi et al. (2003) decidieron estudiar el efecto de una serie de compuestos de plantas relacionados con los taninos y ligninos de estructura conocida. Para dichos estudio realizaron los mismos ensayos que en su trabajo de 1996, pero emplearon un gen reportero distinto: el de la luciferasa (luc). Esta es una enzima aislada de la especie de luciérnaga Photinus pyralis, que genera luz al monooxigenar un sustrato de luciferina. La intensidad de la luz que se genera es proporcional a la cantidad de enzima y puede medirse en un luminómetro (MGT, sin fecha). El gen luc se fusionó con las LTR del VIH-1 en un vector y fue transfectado a células T. De esta manera se observó que el ácido tánico, los elagitaninos (taninos hidrolizables), las cumarinas y las calconas (de la familia de los flavonoides) aislados de distintas plantas, inhibieron la actividad luciferasa inducida por TPA de manera dependiente de la concentración (Figura 10). Los elagitaninos, que mostraron efecto inhibitorio, compartieron una estructura circular compuesta por fenoles y sacáridos responsable de la supresión de la expresión de ciertos genes virales al actuar sobre PARG, por lo que este podría ser el mecanismo involucrado en la inhibición de la expresión de la luciferasa (Uchiumi et al, 2003).
Por otro lado, a pesar de que el mecanismo de acción mediante el cual las calconas y las cumarinas ejercen su efecto inhibitorio no ha sido determinado, se ha sugerido que podría involucrar la unión selectiva a ciertos factores proteicos de transcripción o transducción, ya que compuestos de estructura similar no tuvieron efecto inhibitorio (Uchiumi et al, 2003).
Figura 10. Efecto de los elagitaninos, las cumarinas y las calconas sobre la transcripción de la luciferasa inducida por TPA. Las células transfectadas con el gen de la luciferasa asociado a las LTR del VIH-1 se trataron con TPA en presencia de concentraciones crecientes de los diferentes compuestos. A) Efecto del ácido tánico (T.A) y los elagitaninos (Hirtellin A/B/C, Tamarixinin B, Cocciferin D). B) Efecto de las cumarinas (glicirrisoflavona, glicicumarina, licopiranocumarina, licocumarona) y calconas (Tetrahidroximetoxicalcona, licocalcona A/B) (Uchiumi et al, 2003).
Los inhibidores de la integración del genoma viral: la proteína MAP 30.
La ricina es una proteína que ha sido tradicionalmente conocida por ser extremadamente tóxica al inactivar los ribosomas e impedir la síntesis proteica celular. Se trata por lo tanto de una proteína inactivadora de los ribosomas (PIR) que es capaz de causar un 50 % de muerte celular a concentraciones por debajo de 1 ng/mL (Peumans, et al, 2001). El interés por el efecto citotóxico de la ricina llevó al aislamiento de proteínas funcionalmente relacionadas en una gran variedad de plantas. Una de ellas es la proteína MAP 30 aislada de Momordica charantia, una planta originaria de China cuyos extractos se han utilizado por siglos para el tratamiento de infecciones y tumores (Lee-Huang et al, 1995). A diferencia de la ricina, MAP 30 exhibe una toxicidad selectiva hacia células tumorales e infectadas con virus sin afectar las células normales, por lo que constituye una excelente candidata para la elaboración potencial de fármacos anticancerosos y antivirales. Los mecanismos de reconocimiento de las células alteradas por parte de MAP 30 aún no han sido establecidos (Wang et al, 1999). Las PIR ejercen su mecanismo inhibitorio gracias a su actividad RNA N-glicosidasa que consiste en la ruptura del enlace glicosídico N-C entre una adenina específica y su base nucleotídica. Esto ocurre al nivel de una adenosina situada en la posición 4324 de la subunidad 28 S del RNA ribosomal. Como consecuencia de esta deadenilación los ribosomas son inactivados y la síntesis proteica bloqueada. No obstante, varios indicios sugieren que el efecto anti-VIH de MAP30 no se debe a la deadenilación del rRNA, ya que la proteína es capaz de inhibir la infección por VIH-1 en células T y macrófagos a concentraciones que no muestran efecto sobre los ribosomas (Wang et al, 1999). Además, MAP 30 es capaz de inactivar topológicamente las LTR del DNA del VIH-1, haciéndolas insensibles a la acción de la DNA girasa, una topoisomerasa celular que interviene en el desenrollamiento del DNA durante los procesos de replicación y transcripción del DNA (Lee-Huang et al, 1995). Basándose en estas observaciones, Lee-Huang y colaboradores (1995) decidieron estudiar si también existía algún efecto de la proteína MAP 30 sobre la actividad de la integrasa viral. Para eso sintetizaron fragmentos de DNA marcados con fósforo radioactivo, con secuencias de 21 nucleótidos correspondientes a los extremos de las regiones U3 y U5 del las LTR del VIH-1. Estos fragmentos sirvieron de sustrato para la integrasa viral, cuyo primer paso catalítico consiste en realizar cortes escalados a nivel de los extremos 3? del DNA de doble cadena viral (ver mecanismos de replicación del virus), suprimiendo específicamente el par de nucleótidos GT (Figura 11). Por lo tanto, la acción de la integrasa sobre los fragmentos sintéticos generaría oligonucleótidos de 19 bases que podrían separarse y visualizarse por electroforesis y autorradiografía (Lee-Huang et al, 1995).

Figura 11. A. Representación esquemática del procesamiento de los extremos 3? catalizado por la integrasa del VIH. B. Inhibición del procesamiento de los extremos 3? de los sustratos U3 y U5 LTR. La electroforesis y posterior autorradiografía mostró la formación de dos bandas en los controles, mientras que solo se observó una banda correspondiente al sustrato sin procesar en los experimentos realizados con diferentes concentraciones de MAP 30 (Lee-Huang et al, 1999).
Los investigadores antes mencionados observaron que, al incubar la integrasa en un medio de reacción con los sustratos en presencia de MAP 30, hubo una inhibición en la generación de fragmentos escindidos con relación a los controles no expuestos a la proteína. Vieron que el efecto, tanto en los sustratos U5 como U3, fue proporcional a la concentración de proteína (Figura 11). Esto demostró que la proteína impedía el procesamiento inicial de las LTR por parte de la integrasa. Para estudiar sí la MAP 30 también era capaz de impedir el proceso de transferencia de hebras entre el genoma viral y el genoma del hospedador catalizado por la integrasa, estos autores incubaron la enzima junto a diversas concentraciones de proteína en presencia de los sustratos U5 y U3 carentes de los nucleótidos terminales y de un plásmido receptor. Bajo estas condiciones cualquier inhibición detectada se debería a la interferencia de MAP 30 sobre la transferencia de hebras y no sobre la escisión nucleotídica. Debido a que los sustratos U5 y U3 se encontraban marcados radioactivamente, se pudo hacer un seguimiento de la integración mediante electroforesis y autorradiografía.
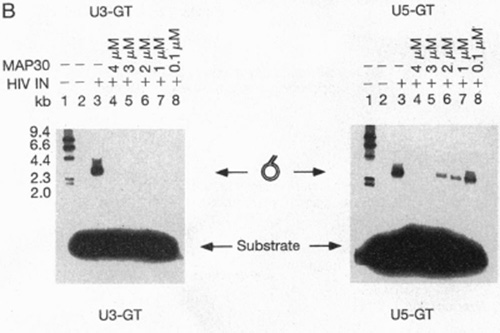
Figura 12. Inhibición de la transferencia de hebras por la acción de MAP30. En el carril uno se corrieron fragmentos marcadores radioactivos producto de la digestión del DNA del fago λ con la enzima de restricción Hind 3. Los controles no expuestos a MAP 30 (carriles 2) presentaron una banda alrededor de 2.69 kB constituida por el fragmento de DNA resultante de la integración. En los carriles de los experimentos con MAP 30 y U3, no se observó la banda o apareció más atenuada (en el caso de U5). La mancha obtenida en la parte inferior representa los sustratos U3 y U5 no integrados (Lee-Huang et al, 1995). Lee-Huang y colaboradores (1995) encontraron que en presencia de MAP 30 (Figura 12), la integración de U3 y U5 con el plásmido se vio inhibida proporcionalmente a la cantidad de proteína, aunque el efecto fue mayor en el caso de U3. Estos datos indicaron que la proteína MAP 30 de Momordica charantia inhibía la integración de las LTR del VIH-1 al genoma receptor. Éstos autores sugirieron que dicha inhibición podría deberse a la actividad glicosilasa/liasa de la proteína, característica de ciertas enzimas que intervienen en el proceso de reparación del DNA (Wang et al, 1999). Éstas son capaces de escindir las bases nucleotídicas y de unir una base correctamente insertada a la cadena de DNA (Klug y Cummings, 1999). El proceso requiere la formación de un intermediario DNA-enzima unido covalentemente. MAP 30 presenta este tipo de actividad enzimática al escindir una base de adenina al nivel de las LTR del VIH-1 y unirse a ellas formando complejos de DNA/MAP 30. Éstos generarían sustratos de LTR inadecuados para la integrasa y la DNA girasa, explicando así los efectos inhibitorios de MAP 30 (Wang et al, 1999). |