Inmunología
Las Células T memoria:un enigma aún por esclarecer
Fases de una respuesta inmunológica
Se han descrito cuatro
eventos o fases principales durante una respuesta inmunológica, los
cuales están íntegramente relacionados a la eventual generación
de células T de memoria: fase de iniciación, fase de expansión
clonal, fase de contracción y finalmente, la generación de células
T de memoria. Siguiendo un encuentro con un antígeno extraño
presentado por células especializadas, tales como las células
dendríticas (CD), las células T proliferan y se diferencian
en células efectoras y memoria (28). Con respecto a las células
T CD8, las células T efectoras se convierten en citolíticas
y producen ciertas citocinas, en particular IFN-γ, mientras que las células
T CD4 producen citocinas (Th1 y Th2) que pueden mediar efectos directos sobre
las células dianas o asistir en la activación de otros mecanismos
efectores del sistema inmunológico (29, 30). Seguidamente a la activación,
se presenta una fase de eliminación de una gran mayoría de células
T específicas, activadas mediante el proceso de la apoptosis, debido
a la privación de factores de supervivencia y a la presencia o ausencia
de citocinas como producto de la desaparición del estímulo antigénico
(31), pero una fracción sobrevive como células de memoria (32-34).
Se han propuesto dos mecanismos responsables de la fase de eliminación
de una respuesta inmune. La primera consiste en una muerte celular inducida
por la activación (AICD, en inglés), la cual depende de la expresión
de Fas y Fas ligando, así como de la producción de IL-2 (35,
36) y ocurre en las primeras fases después de la expansión,
cuando la concentración de antígenos todavía es alta.
Este mecanismo no es inhibido por una sobreexpresión de los factores
anti-apoptóticos Bcl-2 y Bcl-x (37). El segundo mecanismo es pasivo,
debido a la disminución de IL-2 cuando el estímulo antigénico
se está eliminando. Al contrario de la AICD, la muerte pasiva puede
ser prevenida por la sobreexpresión de Bcl-2 y Bcl-x (37, 38). Las
células sobrevivientes son células de memoria, las cuales son
capaces de producir una respuesta más rápida al reencuentro
del mismo antígeno, activando a células T CD8 u otra célula
del sistema inmunológico, dependiendo del contexto en que se activa
este sistema. Si embargo, es importante destacar que repetidos contactos con
una persistente fuente de antígenos conduce a una rápida expansión
seguida por una fase apoptótica por AICD, lo cual no favorece el desarrollo
de memoria (39-42).
Fase
de iniciación | Fase de expansión clonal
| Fase
de contracción celular | Mantenimiento
de las células T de memoria
a)
Fase de iniciación
Se han obtenido evidencias que tres citocinas, (IL-2, IL-7 e IL-15), poseen
un papel crucial para la generación y mantenimiento de las células
T de memoria, especialmente en las células T CD8 (Figura 1). Aunque
sus funciones pueden estar solapadas en algunos casos, sus actividades sobre
las células T pueden ocurrir simultáneamente o en diferentes
puntos temporales durante una respuesta inmunológica. La mediación
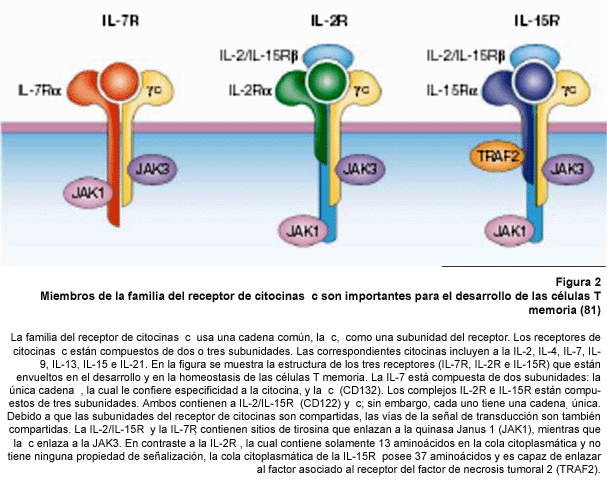
de funciones comunes de estas citocinas es debido, en parte, a que comparten
subunidades del receptor de citocinas y las vías de señalización
(Figura 2). Una cadena β común está presente tanto en el
receptor de IL-2 (IL-2R) como en el receptor de la IL-15 (IL-15R), el cual
señaliza a través de la JAK 1 (Janus kinasa 1, en inglés).
Los tres receptores usan la γc, la cual señaliza a través
de JAK 3 (43). Se piensa que la cadena IL-15Rα tiene habilidades de señalización,
posiblemente a través de una región que enlaza al TRAF2 (tumour-necrosis
factor receptor-associated factor 2) (44), aunque esta posibilidad no ha sido
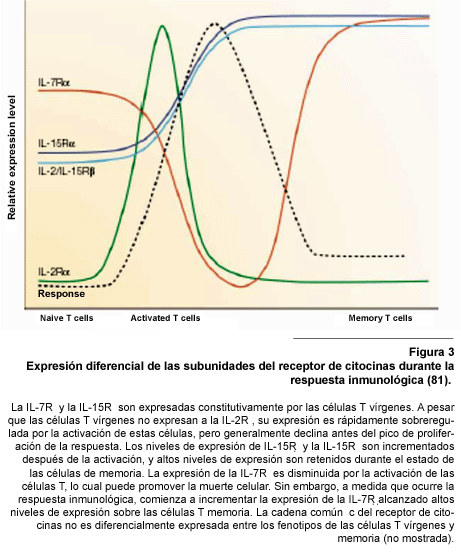
explorada en detalle. Un hecho importante consiste en que parte de la regulación
de los efectos temporales de estas citocinas, se debe a la regulación
diferencial de la expresión de los receptores de las mismas, tal como
se observa en la Figura 3. Por ejemplo, las células T vírgenes
expresan IL-7Rα, IL-15Rα, IL-2β (CD122) y γc, pero no expresan
IL-2R (CD25) (Figura 3). Este patrón de la expresión de receptores
tiene consecuencias funcionales. El IL-7Rα es requerido para la supervivencia
de las células T vírgenes, pero no es conocido si la IL-15 participa
en este proceso. Sin embargo, ratones deficientes de IL-15Rα e IL-15 contienen
la mitad del número normal de células T CD8 vírgenes
(45, 46), lo cual indica que esta citocina es esencial para la producción
o supervivencia de las células T CD8 vírgenes. La expresión
de la IL-7R e IL-15R sobre las células T vírgenes provee una
oportunidad para que sus citocinas correspondientes puedan participar en las
fases iniciales de la activación de la respuesta inmune. Esta activación
celular requiere de antígeno, sin embargo, dependiendo del contexto
en que es identificado el antígeno, determinará el resultado
final la respuesta. Este contexto puede estar alterado por componentes de
la respuesta innata y/o por adyuvantes. Un ejemplo de esto es la unión
de receptores Toll-like (TLRs) y la inducción de la expresión
de IFN-α/β y de otras citocinas, quienes pueden activar las principales
células presentadoras de antígeno, las CD (46, 47).
Se ha descrito que la
producción de la γc de la IL-15 por las CD es activada por las
citocinas IFN-α/β (48) y estas CD activadas expresan ARNm para IL-2
(49). Además, se conoce por pruebas in vitro que la IL-15 es esencial
para la activación óptima de las CD (50). De este modo, una
vía autocrina de la producción de IL-15 e IL-15R, actuando sobre
las CD, puede optimizar la activación de la célula T (Figura
1). Acoplados estos hechos con la demostración de que, la señalización
del TLRs es requerida para iniciar una respuesta de las células T (46),
indican que la producción de citocinas inducida por TLRs podría
ser uno de los eventos tempranos que son esenciales para la iniciación
e integración de la respuesta inmune. De esta manera, las citocinas
controlan la generación de células T de memoria desde el inicio.
Queda por establecer si
las IL-15 e IL-2 producidas por las CD actúan directamente sobre las
células T.
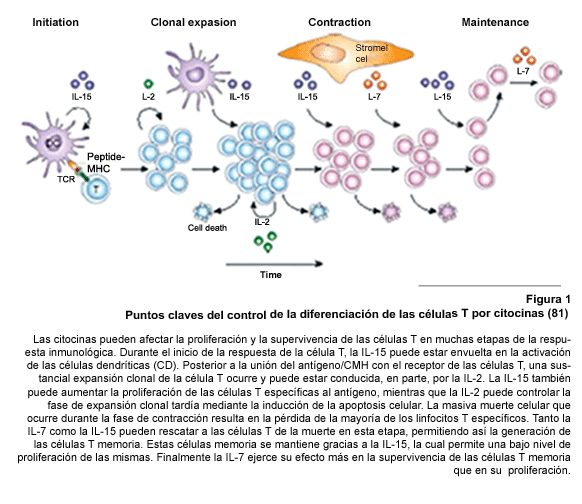
b)
Fase de expansión clonal
Existe un punto controversial referente a la generación de células
de memoria durante la expansión clonal, del cual se han planteado dos
hipótesis: a) las células T CD8, son inducidas a dividirse,
y progresivamente diferenciarse, en células citotóxicas efectoras
(CTLs, lymphocyte T cytotoxic, en inglés) y en células de memoria
después de cada encuentro con el antígeno. En base a este modelo,
la división y diferenciación de las células T CD8 activadas,
son dependientes de una continua estimulación antigénica y las
células pudieran parar al momento de haber sido removido el antígeno.
Si el número de células presentadoras de antígenos está
limitado, y las células son de corta vida, entonces las células
T CD8 no pueden dividirse el número de veces necesario para estimular
los cambios fenotípicos y pueden residir en estados parcialmente diferenciados
(51); b). Alternativamente, puede ser que las células T CD8 están
programadas desde su origen para proliferar y diferenciarse en células
efectoras CTLs y de memoria cuando se encuentren con el antígeno. Este
programa se inicia por la activación de las células T CD8 parental,
las cuales instruyen a las células hijas para dividirse y diferenciarse
en las dos subpoblaciones celulares sin necesidad de la presencia de una fuerte
estimulación antigénica. Este modelo predice que si el antígeno
no es abundante (por ejemplo, durante ciertas infecciones), entonces las células
T CD8, que devienen activadas, son aún capaces de diferenciarse en
células de memoria. Con la aplicación de la técnica de
tetrámeros del complejo mayor de histocompatibilidad (CMH), se han
podido obtener nuevas oportunidades para estudiar la expansión de las
células T específicas al antígeno durante una respuesta
inmune ante una infección (52). Una sorpresiva característica
de esta respuesta es la sincronía de las poblaciones de células
T específicas para el antígeno que difieren en cantidad y estabilidad,
sugiriendo que otros factores, más que la persistencia del antígeno,
determinan la duración de la expansión de las células
T (53). Esta noción fue soportada por tres subsecuentes trabajos que
demuestran, que las células T CD8, requieren solamente de una breve
estimulación para activar un programa de una proliferación prolongada
en la ausencia de una fuerte exposición al antígeno (54-56).
Estos estudios sugieren que el encuentro inicial de las células T vírgenes
con el antígeno, tiene profundas implicaciones para la duración
y la extensión de la proliferación y diferenciación.
En el caso de las células
T CD4, su respuesta es más heterogénea (57, 58), donde los mecanismos
que ocasionan estas diferencias son desconocidos pero pueden estar relacionados
con requerimientos diferenciales para citocinas particulares. Por ejemplo,
se ha demostrado que la diferenciación a células T CD4 de memoria,
no requiere que las células vírgenes pasen por un estado efector
intermedio (59, 60), mientras que las células T CD8 vírgenes,
transitan a través de un estado efector antes de la diferenciación
a una célula T de memoria (8, 55, 56, 61).
La expansión de
las células T durante una infección, resulta de un predominio
de la proliferación con respeto a la muerte celular. En el pico de
la fase de expansión, ambos procesos están balanceados y a partir
de este momento, comienza a predominar la muerte celular donde se inicia la
fase de contracción. Las proteínas pro y anti-apoptóticas
están jugando un papel importante en estos cambios de la tasa de apoptosis.
Se conoce que en las células vírgenes, los niveles de Bcl-2
son relativamente altos, pero comienzan a disminuir en las células
efectoras cuando ellas sufren la expansión/contracción entre
8 a 20 días después de una infección (62).
Por otra parte, las evidencias
indican que la extensión de la expansión clonal primaria de
las células T está correlacionada con el nivel de memoria generada,
por lo que factores que participen en esta expansión estarían
involucrados en la generación de las células de memoria.
Durante la expansión
clonal, la expresión de IL-2R es rápidamente aumentada, pero
de forma transitoria (63, 64), mientras que la expresión incrementada
de IL-15R se mantiene (65) (Figura 3). Numerosas citocinas, tales como IL-2,
IL-4, IL-7 e IL-15, pueden afectar la proliferación y supervivencia
de las células T. Existen evidencias de que la IL-2 autocrina controla
la magnitud de la respuesta de las células T CD8 en tejidos no linfoides
mediante efectos combinados sobre el crecimiento celular y sobre la apoptosis,
pero no es esencial para el crecimiento de las células T CD8 (66).
En el caso de las células T CD4, se conoce mediante experimentos in
vivo, que la IL-2 puede controlar su expansión, a través
de la inducción de apoptosis (67); asimismo se ha observado que la
IL-2 es requerida para la expansión in vitro de las células
T CD4, pero aún no se ha demostrado este efecto in vivo (67-69).
Por otra parte, se ha demostrado que la IL-7 es indispensable para la expansión
homeostática de células T CD4 y CD8 vírgenes, pero no
se requiere para la expansión de células T CD8 antiviral (65,
70). Finalmente, la IL-15 es capaz de inducir in vitro la proliferación
de células T, mediada por el receptor de la célula T (TCR) (71),
contribuyendo así, a la amplitud del pico de la expansión clonal.
Se ha descrito una disminución del 50% de células T CD8 especifica
al VSV (Vesicular Stomatitis Virus) en ratones deficientes de IL-15 (72),
indicando la importancia de esta citocina sobre la generación de células
T CD8 de memoria.
c) Fase de contracción
celular
En el momento que comienza a activarse una respuesta inmune por la presencia
de un antígeno, las células efectoras producidas comienzan a
sufrir de apoptosis, ocasionando un retorno del equilibrio de las poblaciones
celulares que habían proliferado inicialmente. Sin embargo, hay un
pequeño número de estas células que escapan de la muerte
y devienen en células de memoria. Se conoce que la programación
de la apoptosis se inicia desde el mismo momento de la activación de
la respuesta, la cual es independiente de la magnitud de la misma y de la
presencia del antígeno (73). Esto indica que la contracción
es un fenómeno pasivo, aunque el IFN-γ y la IL-2, pueden estar jugando
un papel importante sobre la misma (36, 74, 75).
En el caso de las citocinas
IL-7 e IL-15, se ha observado que son necesarias durante o antes de la fase
de contracción para la estimulación de la producción
de las células memoria (65, 72). Por ejemplo, se ha observado que en
ratones deficientes de IL-15 e IL-15R, comienza a evidenciarse, al principio
de la fase de contracción, un déficit importante de células
T CD8 específicas al antígeno, sin tener en cuenta, si hay un
defecto en el pico de la respuesta (72, 76). En caso contrario, en ratones
transgénicos a la expresión de IL-15, al ser infectados con
Listeria monocytogenes, se produce una fase de contracción mucho más
prolongada en el tiempo y una mayor cantidad de células de memoria
(77). Según estos últimos resultados, los autores proponen que
puede ser por un efecto positivo en la proliferación celular por parte
de la IL-15 y/o por un aumento de Bcl-2 y Bcl-X. Por otra parte, existen diversos
trabajos que demuestran el papel que está jugando la IL-7, especialmente
para la homeostasis de las células T CD8. A pesar que el uso de ratones
deficientes en IL-7 y/o IL-7R les ocasiona una inmunodeficiencia severa, lo
cual hace difícil estudiar si los niveles de IL-7 están aumentados
en una respuesta inmunológica, se han podido obtener algunos resultados
interesantes. Por ejemplo, en reciente estudio usando ratones knock-out para
IL-7 e IL-7R, se demostró que esta citocina es importante para la proliferación
homeostática, tanto de células vírgenes como de memoria
(65). Interesantemente, en ese trabajo se pudo observar que ocurría
una baja regulación de la IL-7R en las células T CD8 activadas,
acompañada de una disminución del nivel de Bcl-2. lo cual afectaba
la expansión de estas células, sugiriendo la relación
que existe entre la IL-7, la Bcl-2 y la tasa de apoptosis. Previamente se
había observado que el efecto de supervivencia que ejerce la IL-7,
se debe en parte a la capacidad que posee esta citocina para aumentar o sostener
la expresión de la proteína anti-apoptótica Bcl-2 (78-80).
Finalmente, en base a
todos estos resultados se ha propuesto la hipótesis que una población
pequeña que retenga expresada la IL-7R, es la que se va a transformar
en células de memoria, gracias al rescate de estas células de
la apoptosis por la presencia de IL-7 (81).
d)
Mantenimiento de las células T de memoria
Similar a las células T vírgenes, las células T de memoria
están en un estado de reposo, sin embargo, ellas retienen muchas de
los atributos funcionales de las células efectoras. Estos atributos
incluyen la expresión de muchas de las moléculas de adhesión
o de interacción celular, rápida producción de citocinas
polarizadas como resultado de la demetilación del promotor de citocinas
y rápida expansión después de la re-estimulación
(7, 82,83).
La homeostasis de las
células T de memoria es mediada por un balance entre un bajo nivel
de proliferación de estas células con la supervivencia y muerte.
Esto es muy diferente a lo que sucede en las células T vírgenes,
las cuales no se dividen y tienen una limitada vida media (84-86). La renovación
y supervivencia de las células T CD4 y CD8 memoria no requiere ni de
antígenos ni del complejo mayor de histocompatibilidad (CMH) (86-90),
aunque las interacciones del complejo TCR/CMH se requieren para mantener la
función de las células T de memoria (90).
A partir de los estudios
de Tough y col., (91, 92) se obtuvieron evidencias de que las citocinas juegan
un papel esencial en el mantenimiento de las células T de memoria en
ratones. Los autores, inyectando en ratones tanto IFN tipo I (IFN-α/β)
como inductores de IFN-γ, lograron estimular la proliferación (independiente
del TCR) de células T CD8 de memoria (CD44hi). Subsecuentemente, se
encontraron otras citocinas, incluyendo IL-12, IL-15, IL-18 e IFN-γ, que
ejercían efectos similares (93, 94) pero notablemente, el aumento de
la proliferación estaba restringido a las células T CD8 CD44hi
(células de memoria) y no se observaba en las células T CD8
vírgenes. De todas estas citocinas, solamente la IL-15 tenía
un similar efecto in vitro en células T CD8 de memoria purificadas,
asociado a una sobreexpresión de la cadena β de la IL-15R (93).
Debido que las citocinas IL-12, IL-18, IFN-α/β e IFN-γ, son capaces
de sobrerregular la expresión de IL-15 por las células presentadoras
de antígenos (las dos primeras por la inducción de IFN-γ),
se ha propuesto que la IL-15 actúa como una molécula común
efectora final, mediando los efectos sobre las células T CD8 de memoria
(93, 94).
Basado en la observación
de que la inyección de IL-15 o la inducción de la sobreexpresión
de IL-15 in vivo, resulta en una proliferación de células
T CD8 de memoria, se hipotetizó que la alta proliferación de
estas células en ratones normales se debía a una producción
basal de esta citocina. Apoyando esta idea, al inyectar anticuerpos anti-CD122
(IL-15R) en ratones, se pudo evidenciar que ocurría una reducción
drástica de la proliferación de las células T CD8 de
memoria (95). A pesar que este anticuerpo puede bloquear la señalización
a través de IL-15R y de IL-2R, parece ser que los efectos inhibitorios
son ejercidos por el bloqueo de IL-15, debido a que la inyección de
anti-IL-2 + anti-IL-2Rα aumenta la proliferación de las células
T CD8 de memoria. Los autores concluyen que estas dos citocinas, IL-15 e IL-2,
tienen efectos antagonistas in vivo sobre la proliferación
de las células T CD8 CD44hi. En el caso de los humanos, se pudo evidenciar
que esta citocina, la IL-15, ejerce un efecto proliferativo en células
T CD4 y CD8 de memoria (96, 97).
Adicionalmente, para estudiar
los mecanismos involucrados en el mantenimiento de las células T de
memoria por la IL-15, se utilizaron ratones deficientes en IL-15 o IL-15R
para medir la renovación de células T CD8 de memoria específicas
al VSV y al LCMV (Virus de la Coriomeningitis Linfocítica) (76, 98).
Los autores encontraron que la incorporación de Bromodeoxyuridine (BrdU)
(marcador de proliferación celular) fue muy deficiente en los ratones
mutantes. Además, se pudo observar que estas células no proliferaban
al ser transferidas a ratones deficientes de IL-15. Finalmente, las células
T CD8 de memoria específicas al LCMV generadas en ratones deficientes
de IL-15, se dividían al ser transferidas a ratones normales, indicando
que cualquier efecto causado por la ausencia de IL-15 es reversible (76).
Los resultados de ambos estudios hace concluir que la IL-15 es esencial para
el mantenimiento de las células T CD8 de memoria por su capacidad de
generar su división.
En el caso de las células T CD4 de memoria, la IL-15 parece ser que
no ejerce ningún papel importante en su proliferación ni in
vitro ni in vivo (93). Se ha observado una cantidad normal de
estas células T CD4 de memoria en ratones deficientes de IL-15 o IL-15R
(45, 99). Además, ratones deficientes de la cadena γ común
presentan células T CD4 de memoria con larga vida, indicando claramente
que ninguna de las citocinas que utilicen este componente del receptor (IL-2,
IL-4, IL-7, IL-9 e IL-15) son esenciales para la supervivencia de esta población
celular (100). De este modo, si las citocinas juegan un papel sobre el mantenimiento
de las células T CD4 de memoria, los factores involucrados son claramente
distintos de aquellos que ejercen efectos sobre las células T CD8 de
memoria y/o vírgenes. Sin embargo, es importante señalar que
en el caso de los humanos, se han obtenido evidencias de que la IL-15 ejerce
un efecto proliferativo en células T CD4 de memoria (96, 97), lo cual
hace pensar que los procesos responsables del mantenimiento de las células
T CD4 de memoria son diferentes entre distintas especies.
Como se ha observado,
el mantenimiento de las células T de memoria es dependiente de la IL-15,
sin embargo, una de las preguntas que queda en el aire es si esta citocina
interviene en la función de estas células. Para responder a
esta cuestión, el trabajo de Becker y col., (76) pudo constatar que
la funcionalidad de las células T CD8 de memoria específicas
a LCMV, expresada como la producción de citocinas efectoras, era normal
en la ausencia de la IL-15. Los autores obtuvieron resultados donde se observa
una producción similar de IFN-α y TNF-α por células
T CD8 de memoria específicas a LCMV en ratones deficientes de IL-15
o IL-15R con respecto a ratones normales, indicando claramente que la IL-15
parece ser que no ejerce ningún efecto sobre la funcionalidad de las
células T CD8 de memoria.
Por otra parte, el papel
de la IL-7 sobre la supervivencia de las células T de memoria se ha
investigado debido a que estas células presentan una gran expresión
de IL-7R (Figura 3) y esta citocina es un factor de supervivencia de la célula
T (65, 98, 101, 102). Ratones transgénicos que expresan la IL-7 bajo
el control de un promotor del CMH clase II, presentan un número alto
de células T CD8 de memoria, el cual no está asociado a un aumento
de la tasa de proliferación de estas células (103). Además,
la IL-7 tiene la capacidad de mantener la sobrevida de un subgrupo de células
T de memoria que no se dividen de forma constitutiva. Efectivamente, hay una
pequeña población de células T CD8 de memoria específica
a VSV o LCMV, que persiste después de un año de haber sido infectados
ratones deficientes de IL-15 o IL-15R, indicando que la IL-15 no se requiere
de forma absoluta para ejercer esta función de supervivencia (65, 76).
Aunado a esto, se ha observado que esta población celular no declina
en el tiempo en la ausencia de IL-15, sugiriendo que otro factor está
interviniendo en este fenómeno. Se ha propuesto que es la IL-7 la protagonista
de este fenómeno. Efectivamente, bloqueando la IL-7R con un anticuerpo
monoclonal inyectado en ratones deficientes en IL-15, se encontró una
mayor deficiencia de células T CD8 de memoria (102). Todos estos resultados
hacen concluir que la IL-15 e IL-7, intervienen en diferentes parámetros
para el mantenimiento de las células T CD8 de memoria. Por un lado,
la IL-15 interviene en la regulación de la renovación celular,
y por el otro lado, la IL-7, ejerce su papel homeostático en la supervivencia
de las células T CD8 de memoria. |