Figura
4. Expresión
del gen de la insulina. Se
esquematizan de arriba abajo la estructura del gen de la insulina, el ARNm
maduro, la proteína traducida a partir del mismo, preproinsulina y su
maduración hasta producir insulina. Las letras corresponden a: I a los
intrones, U a las regiones no traducidas, L al péptido líder, B a la cadena B,
C al péptido C y A a la cadena A.
La primera etapa en la
síntesis de la insulina ocurre a nivel de los ácidos nucleicos, el ARN
transcrito primario mediante el mecanismo del “splicing” (eliminación de
intrones y empalme de exones) pierde los dos intrones, en el extremo 5’ se le
adiciona 7-metil guanosina (casquete) y en el extremo 3’ se le añade la cola de
poliadenina (poli A) obteniéndose el ARMm maduro el cual es traducido en el
retículo edoplamático rugoso para dar preproinsulina.
Como ocurre con otras
proteínas secretadas, la preproinsulina (Figura 5) contiene un péptido señal o
líder amino terminal hidrofóbico de 24 aminoácidos, el cual al ser sintetizado
en los ribosomas y antes de concluir la síntesis total de la proteína, se une
en el citosol a partículas ribonucleoproteicas que reconocen al péptido señal
(SRP por sus siglas en inglés) (15). Dichas partículas facilitan que
la preproinsulina sea translocada a través de la membrana del retículo
endoplamático hasta la cisterna del mismo. Este proceso ocurre por medio de un
canal especializado que conduce péptidos (16), una vez en la
cisterna del retículo endoplasmático, el péptido señal de la preproinsulina es
hidrolizado gracias a la participación de una peptidasa señal generándose la
proinsulina (17).
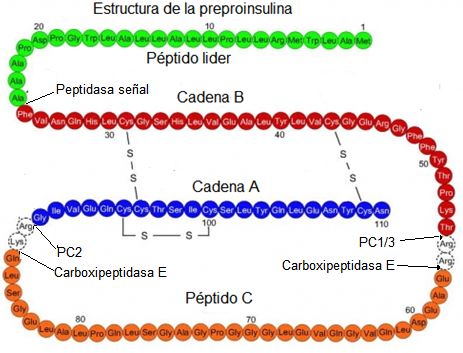
Figura
5. Estructura
de la preproinsulina humana. En el
esquema se representa la secuencia de aminoácidos de la preproinsulina humana.
En verde se destaca el péptido líder o señal, en rojo la cadena B, en naranja
el péptido C, en azul la cadena A y en transparente los aminoácidos de ambos
extremos del péptido C que son eliminados durante el procesamiento de la
proinsulina. Se destacan los sitios de acción de las proteasas: peptidasa
señal, PC2, PC1/3 y carboxipeptidasa E
El péptido señal es prontamente
degradado y en consecuencia no es un producto de secreción de las células
β. A continuación la proinsulina se
pliega y ocurre la formación de los tres enlaces disulfuro (18)
proceso que requiere una variada gama de proteínas chaperonas del retículo
endoplasmático tales como la reductasa de grupos tioles de las proteínas (19).
Luego de adquirir el plegamiento tridimensional, la proinsulina es transferida
del retículo endopasmático al aparato de Golgi y entra a vesículas secretoras
inmaduras.
La proinsulina a pesar de su
mayor tamaño comparte varias de las características físicas de la insulina, la
proinsulina forma dímeros y hexámeros de coordinación con el Zn2+,
tienen puntos isoeléctricos similares, igual solubilidad y reacción cruzada con
los anticuerpos. Estos hallazgos sugieren que la estructura de la insulina en
la proinsulina esta conservada y que el péptido C, de unos 35 aminoácidos,
tiene una configuración flexible pero no completamente desordenada.
La conversión de proinsulina
en insulina se inicia en el trans Golgi y se acelera en los gránulos
prosecretarios en la medida en que estos
se acidifican y maduran, la misma tiene lugar por la participación de unas
endopeptidasas similar a la tripsina y
una exopeptidasa similar a la carboxipeptidasa B. En los gránulos secretorios
existen dos endoproteasas que participan en la conversión de proinsulina en
insulina denominadas PC2 y PC1/3, la primera hidroliza después de los
aminoácidos básicos Lys-Arg en la unión péptido C/cadena A y la segunda
preferentemente hidroliza antes del dipéptido Arg-Arg en la unión cadena B/
péptido C aun cuando puede actuar en ambos extremos (Figura 5). Ambas
endopeptidasas presentan un pH óptimo cercano a 5,5 consistente con el
encontrado en los gránulos secretores de las células β, el cual se alcanza
gracias a la participación de una bomba de protones presente en dichos gránulos
secretorios (20). La enzima que elimina los dipéptidos básico
después de la acción de PC2 y PC1/3 se denomina carboxipeptidasa E (Figura 5).
Los estudios cinéticos han demostrado que primero actúa PC1/3 generando un
intermediario y luego lo hace PC2 y por último la carboxipeptidasa E. A
diferencia del péptido líder, el péptido C no es hidrolizado y es secretado
junto con la insulina en cantidades equimolares.
La insulina recién
sintetizada forma cristales con el Zn2+, el cual es transportado al
interior de los gránulos por un transportador denominado ZnT8 (21),
dichos cristales se acumulan en el centro electrón denso de los gránulos y en
la periferia menos densa se encuentra el péptido C.
Las insulinopatias clásicas:
insulina Chicago en la cual se sustituye la Leu B25 por Phe (22) ;
insulina Los Ángeles en la cual se reemplaza la Phe B24 por Ser (23)
e insulina Wakayama en la cual se sustituye Val A3 por Leu (23)
resultan de mutaciones puntuales acumulándose
en la sangre las insulinas mutantes las cuales presentan una menor capacidad
para unirse al receptor de insulina y en consecuencia una menor actividad
biológica. Síndromes clínicos raros resultan de mutaciones en otros sitios que
afectan etapas claves en la biosíntesis de la insulina (23).