El genoma humano codifica 55
receptores con actividad de tirosina quinasa los cuales se agrupan en 19
subfamilias dependiendo de su estructura y características funcionales, en
general están constituidos por un monómero el cual se dimeriza al unirse al
ligando. La subfamilia del receptor de la insulina comprende: el receptor de la
insulina (IR por sus siglas en inglés), el cual une insulina; el receptor del factor de crecimiento similar
a la insulina, el cual une los factores
de crecimiento similares a la insulina I y II y el receptor huérfano
relacionado con el receptor de la insulina, el cual no posee ligando conocido.
Los miembros de esta subfamilia existen como dímeros aun en ausencia de ligando
(7).
El IR tiene una estructura
modular y es codificado por un gen ubicado en el cromosoma 19p13.2, el mismo
posee 22 exones (secuencias del ADN o preARNm que codifican secuencia de
aminoácidos en la proteína) y 21 intrones (secuencias del ADN o preARNm no codificantes).
El exón 11, que codifica un segmento de 12 aminoácidos, puede ser
alternativamente eliminado (splicing: eliminación de intrones y unión de
exones) generando 2 isoformas del IR, a saber la isoforma A donde no se expresa
el exón 11 y la isoforma B en la cual se expresa el exón 11, las cuales
difieren discretamente en su afinidad por la insulina y su expresión en los
tejidos, la isoforma A se encuentra en los tejidos fetales y la B en el hígado.
Los IR son sintetizados como un proreceptor el cual es procesado por una enzima
proteolítica del tipo de las furinas para formar las subunidades α y β, la
subunidad α es abundantemente glicosilada, se forman los enlaces difulsuro y
adquieren la estructura tridimensional(8). El receptor de insulina
es un heterotetramero constituido por 2 subunidades α y 2 β (α2β2).
Las dos subunidades α son extracelulares y las dos subunidades β comienzan en
la región extracelular, luego atraviesan la membrana plasmática y terminan en
la región intracelular. Las 2 subunidades α están, altamente glicosiladas,
unidas por 2 enlaces disulfuro (probablemente 4) y cada subunidad α se une a
una subunidad β por un enlace disulfuro. Uno de los sitios de unión de la insulina está ubicado en las subunidades
α y el otro en la interacción de las subunidades αβ; la porción citoplasmática
de la subunidad β contiene el dominio de tirosina quinasa (9).
Las subunidades α están
constituidas desde su extremo amino terminal por: un dominio rico en el
aminoácido leucina (L1), seguido por un dominio rico en cisteína (C), luego un
segundo dominio rico en leucina (L2), a continuación un dominio completo de
fibronectina tipo III (F1), seguido de un dominio incompleto de fibronectina
tipo III (F2) para terminar en un largo segmento carboxilo terminal (dominio
inserto, ID por sus siglas en inglés) (Figura 1)(10).
![]()
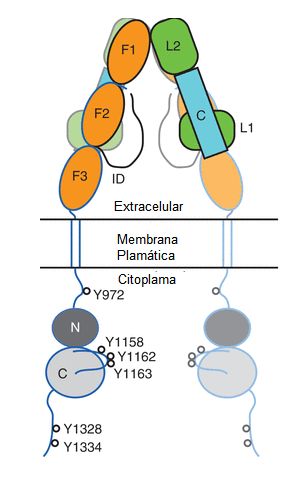
Figura
1. Estructura esquemática del receptor de Insulina. Las
subunidades α, están ubicadas en la porción extracelular (en el esquema
delineadas en negro) y constituidas por: un dominio rico en leucina (L1) luego
un dominio rico en cisteína (C) seguido por otro dominio rico en leucina (L2) a
continuación esta un dominio completo de fibronectina III (F1) seguido por uno
incompleto de fibronectina III (F2) finalizando en un largo segmento carboxilo
terminal (ID). La subunidad β se encuentra tanto en la parte extracelular como
en el citoplasma y está delineada en azul, comienza con un corto dominio amino
terminal (no se muestra en el esquema), seguido por el complemento del dominio
de fibronectina III F2, a continuación se encuentra un dominio completo de
fibronectina III (F3), luego está el segmento α helicoidal transmembranoso. En
la parte citoplasmática de la subunidad β se encuentran la porción
yuxtamembranosa seguida por el dominio de tirosina quinasa formado por los
lóbulos N y C, en el cual se destaca el asa activadora, por último está en
extremo carboxilo terminal. Se destacan las tirosinas (Y) que son
autofosforiladas por el receptor.
Las subunidades β comienzan
por un corto segmento amino terminal seguido por la porción final del dominio
F2 de fibronectina tipo III seguido por un tercer dominio completo de
fibronectina tipo III (F3) el cual se continua con el segmento de
transmembrana, se piensa que el mismo adopta un configuración α helicoidal. La
porción citoplasmática de la subunidad β está constituida por una porción
yuxtamembranosa de unos 30 aminoácidos seguido del dominio de tirosina quinasa
de unos 300 aminoácidos en el cual se describen dos lóbulos designados N y C,
por último se encuentra la región carboxilo terminal de unos 70 aminoácidos
(Figura 1)(10).
Dado que el receptor comprende
porciones extra e intracelulares, incluyendo un segmento que atraviesa la
membrana plasmática y que posee una gran cantidad de carbohidratos, ha sido
difícil realizar estudios cristalográficos de la molécula completa, en
consecuencia los estudios tridimensionales han estado confinados a los dominios
intra y extracelulares. La estructura del dominio extracelular muestra una
conformación de simetría doble antiparalela (el extremo amino terminal de una
subunidad α se aproxima y empaqueta al extremo carboxilo terminal de la otra
subunidad α) de una “V” invertida, los dominios F1, F2 y F3 están dirigidas
como un tallo lineal desde la membrana plasmática hacía afuera y los dominios
L1, C y L2 de nuevo hacía la membrana plasmática; así mismo los dominios L1, C
y L2 de un monómero αβ se empaquetan contra las dominios F1, F2 y F3 del otro
monómero(11) (Figura 1).
Se describen dos sitios de
unión del receptor a la insulina: el sitio 1 está formado por el primer dominio
rico en leucina (L1) de una subunidad α y los 16 aminoácidos finales del
extremo carboxilo terminal del dominio ID de la otra subunidad α. Se piensa que
el sitio 2 de unión a la insulina involucra las asas de los dominios de
fibronectina III, F1 y F2 de las subunidades αβ de la otra mitad del receptor; el sitio 1 se considera el más importante de
los sitios de unión de la insulina a su receptor(12).
El análisis cristalográfico
de la porción citoplasmática de la subunidad β ha sido realizado en varios
estados de fosforiloación y en presencia y ausencia de substratos (Mg++
ATP y proteínas). El lóbulo amino terminal N, presenta cinco cadenas de lámina
plegada (configuración β) y una porción α helicoidal; por otro lado el lóbulo
carboxilo terminal C principalmente tiene una estructura α helicoidal (13).
La actividad de tirosina quinasa, del IR, está regulada por el estado de
fosforilación del asa de activación presente en el lóbulo C la cual comienza
con el tripeptido 1150aspartico-fenilalania-glicina
y se extiende hasta la prolina 1170, en la misma se encuentran tres sitios de
autofosforilación, las tirosinas: 1158; 1162 y 1163 las cuales son fosforiladas
en trans cuando el dominio
extracelular se une a la insulina (la unión de la insulina ocurre en un dímero
αβ y la fosforilación ocurre en el otro) (13).
Aun cuando IR es un heterotetrámero
(α2β2) se piensa que el complejo de activación ocurre por
la unión de una sola molécula de insulina asimétricamente al IR con una
afinidad en el orden subnanomolar (0,2 nM), en consecuencia el cambio
conformacional ocurre (o principalmente ocurre) en uno de los dímeros αβ. A
concentraciones mayores de insulina se observa un efecto cooperativo negativo
para la unión a los dos sitios equivalentes en IR(14). Los dos
sitios de unión a la insulina están opuestos cercanamente, sugiriendo que los
cambios conformacionales inducidos por la unión de la hormona al IR sean
relativamente sutiles(15).
En ausencia de insulina,
condición basal, la transfosforilación del dominio de tirosina quinasa está
limitado por un mecanismo desconocido, la unión de la insulina al dominio
extracelular induce una transición estructural en el receptor que facilita la
transfosforilación del dominio citoplasmático de tirosina quinasa. Existen al
menos dos posibles explicaciones para la condición basal: la primera postula
que los dominios de tirosina quinasa están espacialmente separados lo cual
impide el proceso de transfosforilación, en la segunda, los dominios de
tirosina quinasa se encuentran próximos espacialmente pero dispuestos de tal
manera que se impide la transfosforrilación, probablemente por la existencia de
un dímero inhibitorio(16).
En la condición basal y en
la ausencia de Mg++ ATP el asa activadora adopta una configuración
que ocluye el sitio de unión del ATP con lo cual se previene la autofosforilación
de las tirosinas en cis, esto es debido a que la longitud del asa activadora es
tal que no permite la unión simultanea del ATP y la tirosina a fosforilarse
(Y1162) al sitio activo (17).
Se demostró que la primera
tirosina en autofosforilarse, en el asa activadora, es la 1162 seguida por las
tirosinas 1158 y 1163(18). En la estructura cristalina, se ha podido
observar que la tirosina 1162 de una subunidad αβ de IR se encuentra unido al
centro activo de la subunidad αβ contralateral (en trans); esta configuración
se adopta gracias a la fuerte unión del ATP lo cual fuerza al asa activadora a
separarse no ocluyendo el sitio de unión del nucleótido (19).
Una vez que IR es transfosforilado
en las tirosinas 1158; 1162 y 1163, el asa activadora es estabilizada en una
conformación óptima para unir los substratos: Mg++ ATP y las
tirosinas de las proteínas y para que ocurra la catálisis. Aun cuando la
fosforilación de la tirosina 1163 es la más importante para la estabilización
del asa activadora, la fosforilación de las tres tirosinas es importante para
la unión a los substratos del receptor (10).
Además se fosforila una
tirosina en la región yuxtamembranosa (Y 972) la cual es importante para la
unión y activación de las proteínas substratos del IR (IRS por sus siglas en
ingles) y de las proteínas Shc (son 3 proteínas de PM 46; 52 y 66 KDal que
poseen en extremo amino terminal dominios de unión a fosfotirosina y en el
extremo carboxilo terminal dominios SH2). Así mismo se fosforilan 2 tirosinas
(Y1328 y Y1334) en la porción carboxilo terminal (10).
El mecanismo y la cinética
de la unión de la insulina a su receptor ha sido ampliamente estudiado(3),
la misma es compleja y muestra
cooperatividad negativa; solo una molécula de insulina se une al receptor con
alta afinidad y la unión de otra molécula de insulina lo hace con baja afinidad
probablemente por asimetría inducida por ligando.
En la insulina se describen
2 sitios de unión al receptor, el sitio 1 o “superficie de unión clásica” incluye
aminoácidos de ambas cadenas, siendo los de la cadena A: A1 Gly, A5 Gln, A19
Tyr y A21 Asn y los residuos de la cadena B son: B12 Val, B16 Tyr, B24 Phe, B25 Phe y B26 Tyr. En sitio
2 están incluidos también aminoácidos de ambas cadenas: Ser
A12, Leu A13, Glu A17, His B10, Glu B13 y Glu B17. En general se acepta que el
sitio 1 de la insulina se une al sitio 1 de IR y el sitio 2 de la insulina se
une al sitio 2 del receptor (3).
Aun cuando se ha progresado
bastante en el conocimiento de la estructura de los dominios extracelular y
citoplasmático del IR, en la actualidad no se disponen de estudios
cristalográficos del receptor completo en la presencia y ausencia de
insulina y en consecuencia no se dispone
de información sobre como la unión del ligando al dominio extracelular
condiciona la activación del dominio citoplasmático de tirosina quinasa(7).
Existe controversia sobre el tipo de cambio conformacional que ocurre y si el
incremento de la actividad de tirosina quinasa ocurre por activación o por
eliminación de una actividad inhibitoria.