La activación de proteína quinasas
por la insulina está sujeta a la acción opuesta de proteína fosfatasas y de
mecanismos de retroalimentación negativos, el balance adecuado entre ambos
procesos garantiza una apropiada sensibilidad a la insulina y su alteración
condiciona resistencia a la acción de la hormona. A continuación pasaremos
revista a los mecanismos más importantes de control negativo:
-
Fosforilación de serinas en IRS. La
fosforilación en algunas serinas específicas, promovida por la estimulación por
insulina, de IRS condicionan que los mismos no sean reconocidos por IR y/o que
no puedan unirse a la subunidad reguladora de PI3K (p85) o aún más que se
promueva su degradación (41) (Figura 5).
-
Fosfatasa
de fosfotirosinas o fosfoserinas/treoninas. La actividad de proteína
fosfatasas que actúen sobre tirosinas fosforiladas como la 1B (PTP1B por sus
siglas en inglés) atenúan la respuesta a la insulina por promover la
defosforilación de IR y de los IRS(42). Otro punto de
control negativo lo constituye la defosforilación e inactivación de AKT/PBK y
aPKC por proteína fosfatasas de serina/treonina 2A(43) (Figura 5).
-
Fosfatasas de lípidos. La
fosfatidilinositol-3; 4; 5-trisfosfato 3-fosfatasa (PTEN por sus siglas en
inglés) es una enzima que hidroliza a PIP3 (3; 4; 5) a PIP2 (4;
5) y la fosfatasa de fosfoinositol que contiene dominio SH2 (SHIP2 por sus
siglas en inglés) la cual hidroliza PIP3 (3; 4; 5) a PIP2 (3;
4). La activación de estas enzimas reducen la cantidad de PIP3 con
lo cual se reduce la actividad de AKT/PKB y aPKC disminuyendo los efectos de la
insulina(44).
-
Endocitosis del receptor. IR unido a la
insulina es internalizado por endocitosis mediada por clatrina para ser
reciclados o degradado en los lisosomas(45) (Figura 5).
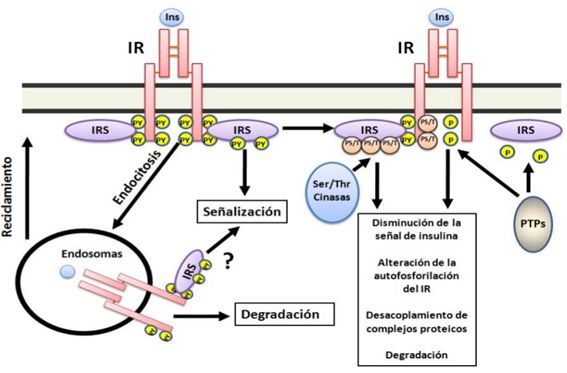
Figura
5. Mecanismos de regulación de la señal de insulina. La
acción de la insulina es modulada por diferentes mecanismos entre los destacan:
la actividad de proteína fosfatasa de tirosina (PTP) que defosforilan residuos
de tirosina tanto en IR como en IRS inactivándolos; fosforilación en
serinas/treoninas en IR y en IRS con lo cual son menos activos y la
internalización de IR unido o no a la insulina para reciclarlo o degradarlo.
En las vesículas
endocíticas, puede ocurrir el inicio de
la degradación de la hormona gracias a la participación de una enzima
específica que degrada insulina (IDE por sus siglas en inglés) o ser
transferida intacta a otros organelos intracelulares como el núcleo, el aparato
de Golgi, el citosol, entre otros (46) o su liberación de la célula
intacta por diacitosis o retroendocitosis (46). La degradación de la
insulina se puede considerar como un mecanismo de terminar su acción.
Conclusiones
Se ha progresado mucho en el
conocimiento de la estructura y el mecanismo de IR; faltan estudios
cristalográficos del receptor en su conjunto y el conocimiento del mecanismo
implicado en la transfosforilación del dominio citoplasmático de IR luego de la
unión a la insulina.
Los nódulos más relevantes
de la red de señalización intracelular de la insulina han sido aclarados, aun
cuando faltan algunos aspectos críticos de los mismos en particular en lo
relacionado con la exocitosis de las vesículas que contienen el GLUT4.
Una mejor comprensión
del mecanismo de acción de la insulina posiblemente facilite el desarrollo de
nuevos fármacos, útiles en el tratamiento de la diabetes, más eficientes y con
menores efectos indeseables.