Farmacología
Efecto nefrotóxico causado por cisplatino mediante su acumulación a través de proteínas transportadoras
Nefrotoxicidad del cisplatino causada por la acumulación del fármaco.
Estudios farmacocinéticos han demostrado que la acumulación de cisplatino es más elevada en el riñón que en otros tejidos o en el plasma 5,8. Gran parte de esta nefrotoxicidad viene dada como se describió en el apartado anterior por la actividad de los transportadores OCT, MATE1 y 2 y MRP2. Se ha reportado ampliamente que los transportadores OCT-2 y MATE-1 son los responsables de generar la acumulación de cisplatino en las célulasepiteliales del túbulo proximal del riñón, lo que produce el efecto nefrotóxicoe induce la muerte celular vía apoptosis 9,10. Un estudio determinó que la citotoxicidad del cisplatino medida a través de la liberación de la enzima lactato deshidrogenasa (LDH) al medio en respuesta al tratamiento en células embrionarias de riñón (HEK293) a las cuales se les transfectó el gen del OCT-2 humano (hOct2), se incrementó de forma dosis dependiente al igual que la acumulación de platino en las mismas, al ser comparadas con células transfectadas con los transportadores OCT-1 y OCT-3. Por otro lado, el transporte de agentes con platino como cisplatino en la membrana apical fue mediado en forma mayoritaria por el transportador hMATE-1, que fue también transfectado en células HEK293, sin embargo el efecto citotóxico del cisplatino a través de la expresión de este transportador no se modificó. Esto indicó que el cisplatino efectivamente es transportado desde la membrana basolateral de la célula tubular por el transportador OCT-2 y expulsado hacia la membrana apical por MATE-1, produciéndose acumulación en la célula tubular11. Esquemáticamente, en la figura 1 se puede observar como el cisplatino es débilmente expulsado de la célula tubular en comparación con otros agentes platinos como el oxaliplatdno.
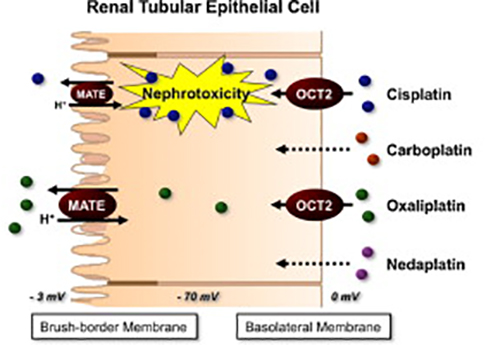
Figura 1. Transporte renal de cisplatino en la célula epitelial del túbulo proximal. El cisplatino al igual que el oxaliplatino es transportado al interior celular mediante OCT2, aunque en mayor concentración. Sin embargo, el cisplatino se acumula en la célula debido a que su salida a través de MATE-1 es débil en comparación a oxaliplatino, lo que produce el efecto nefrotóxico. Tomada de Yonesawa y col. 2011. Estos estudios además de reportar la importancia de los transportadores OCT-2 y MATE-1 en las células epiteliales del túbulo proximal sobre la nefrotoxicidad del cisplatino, sugerían que estas proteínas podían llegar a ser blancos terapéuticos para disminuir la nefrotoxicidad del cisplatino. Es así como se determinó que la cimetidina podía competir con el cisplatino e inhibir la muerte celular por apoptosis, lo que disminuía la nefrotoxicidad inducida por cisplatino10. Más tarde, se reportó que en ratones con ausencia de los transportadores OCT1 y OCT2 (Oct1/2(-/-)) que fueron tratados con cisplatino, se observó la disminución de la proporción de la depuración renal y la tasa de filtración glomerular (TFG) comparada con la de ratones silvestres, lo que indicó que la secreción tubular de platino fue completamente eliminada en comparación con los tipo silvestres. Además, en este mismo estudio se observó que la excreción urinaria de N-Acetil-β-D-glucosamina (NAG) en los ratones con la mutación disminuyó significativamente en comparación con los ratones silvestres, en los cuales se encontraba elevada. Esto contribuyó a resaltar la importancia de NAG como biomarcador de nefrotoxicidad inducida por cisplatino, la cual posteriormente fue utilizada para evaluar el potencial renoprotector que posee la cimetidina, un inhibidor de diferentes isoformas del intercambiador Na+/H+ en ratones tanto silvestres como mutados tratados con cisplatino. Se observó que la actividad de NAG urinario disminuyó significativamente en los ratones Oct1/2(-/-) y ligeramente en los silvestres12. Esto indica una vez más que la cimetidina puede ser utilizada como inhibidor competitivo del cisplatino para disminuir sus efectos nefrotóxicos. En el túbulo proximal además del transporte de cationes orgánicos se produce transporte de aniones orgánicos, a través de la familia de transportadores aniónicos orgánicos (OAT), uno de ellos, OAT5 (SLC22a19) es exclusivamente expresado en los riñones, específicamente en la membrana apical de los segmentos S2 y S3 del túbulo proximal y ha sido caracterizado e implicado como posible biomarcador en la injuria renal aguda (IRA) isquémica, debido a que se ha observado un incremento de esta proteína en orina. Basado en esto, Bulacio y col. en 201313 evaluaron la importancia de Oat5 como biomarcador de la nefrotoxicidad del cisplatino comparado con los marcadores tradicionales de IRA. Estos investigadores reportaron que en ratas, los niveles de excreción urinaria de Oat5 son significativamente más elevados con todas las dosis de cisplatino utilizadasal ser comparadas con los animales control, comprobándose que a la dosis más alta de cisplatino, ocurría el daño renal más grave, esto fue determinado a través de glucosa y proteínas en orina, donde a la dosis más alta de cisplatino estos parámetros estaban incrementados significativamente respecto a las dosis más bajas y animales control. A su vez, determinaron que la expresión de este transportador en la membrana apical del riñón de estos animales disminuía progresivamente de forma dosis dependiente, lo que sugirió una disminución en su síntesis o aumento en su degradación debido al daño tubular causado por cisplatino. Esto indicó que el transportador Oat5 también es un posible biomarcador en la nefrotoxicidad causada por cisplatino, el cual tiende a ser más sensible que los marcadores de la injuria renal. A través de los transportadores de expulsión de fármacos también se han estudiado mecanismos por los cuales ocurre la nefrotoxicidad del cisplatino, mediante la modificación de expresión genética de estas proteínas. En este caso, se determinó que en ratones donde se suprimía el gen para la expresión del transportador MRP2 hubo un incremento dos veces más elevado de los marcadores renales (BUN y creatinina sérica) y cuatro veces más alto de la expresión del ARNm de proteínas de daño renal (molécula-1, metalotioneína-1 y hemo-oxigenasa-1) a los 4 días luego de la aplicación de cisplatino, al compararse con ratones tipo silvestre. De igual forma, las concentraciones de platino en los riñones fueron cuatro veces más altas en estos ratones mutantes que en los silvestres a las 48 horas de aplicado el tratamiento y en el hígado a las 72 horas. Además, la expresión de los transportadores OCT-2, MATE-1 y CTR-1 fue similar en ambos genotipos. Al generar un ratón transgénico con el gen MRP2 humano insertado en los ratones que carecían del gen, se observó disminución de la nefrotoxicidad que se había generado anteriormente14. Todo esto indica que no solo la expresión del transportador MATE-1 sino también MRP2 es crucial en la producción de la nefrotoxicidad del cisplatino, pues su ausencia incrementa la aparición de este efecto tóxico. |