Neurociencia
Transducina: La proteína G del proceso de excitación visual
Estructura de la transducina
Un mejor entendimiento de los cambios conformacionales inducidos por GTP, así como de los mecanismos catalíticos de la actividad GTPasa de las subunidades a de las proteínas G, ha sido obtenido de las estructuras tridimensionales publicadas durante la última década. Las estructuras cristalinas de un fragmento de 325 aminoácidos de Ta ligado a GTPg S, GDP, o GDP-ALF4- han sido reportadas. Estas estructuras mostraron que Ta se encuentra conformada por dos dominios, un dominio GTPasa (o dominio G), involucrado en el enlazamiento e hidrólisis del GTP, y que es estructuralmente idéntico al de las proteínas RAS, al de otras GTPasas pequeñas y al de los factores de elongación; y un dominio a -helcoidal que es único para las proteínas G heterotriméricas (Fig. 6). El nucleótido de guanina se enlaza fuertemente en una hendidura localizada entre estos dos dominios. El plegamiento de estas tres estructuras cristalinas demostró cambios dependientes del nucleótido que distinguen la forma inactiva, el estado de transición, y la forma activa de la proteína. Lo interesante es que estos cambios no son globales, sino que se encuentran restringidos a tres regiones adyacentes localizadas en una de las caras de la proteína, las cuales corresponden solamente al 14 % de los aminoácidos. Estas regiones fueron denominadas regiones interruptoras o "switches" I, II, y III.
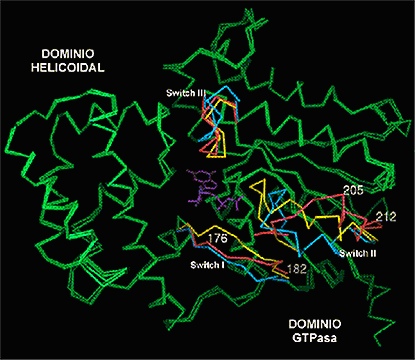
Figura 6. Diferencias estructurales entre la forma inactiva, la forma activa, y el estado de transición de Ta. Ta está compuesta de dos dominios, el dominio GTPasa y el dominio a-helicoidal. El nucleótido (púrpura) calza en un bolsillo de enlazamiento que se localiza entre estos dos dominios. La figura representa la superposición de las estructuras cristalinas de Ta-GDP, Ta-GTPgS, y Ta-GDP-AlF4- (Noel et al., 1993; Lambright et al., 1994; y Sondek et al., 1994), empleando el modelo de bolas y varillas, el cual únicamente muestra los carbonos a del esqueleto polipeptídico. Las principales diferencias entre las estructuras de Ta-GDP (azul),Ta-GTPgS (amarillo), y Ta-GDP-AlF4- (rojo carmesí) están localizadas en las regiones interruptoras o switches I, II, y III. El resto de la cadena de Ta (verde) casi no diverge entre las tres formas. Tomado de Hamm (1997).

Más recientemente, en 1996, la estructura cristalina de rayos X del complejo Tb g también fue reportada. Tb tiene una estructura enriquecida en hebras b que se pliega en forma de hélice propulsora de siete miembros, como consecuencia de sus siete repeticiones WD-40. Tg muestra un plegamiento extendido, con extensivas interacciones con Tb por intermedio de contactos que ocurren en toda la base de Tb , así como también a través de una estructura tipo espiral enrollado que ocurre en las regiones N-terminales de ambas subunidades (Fig. 7).
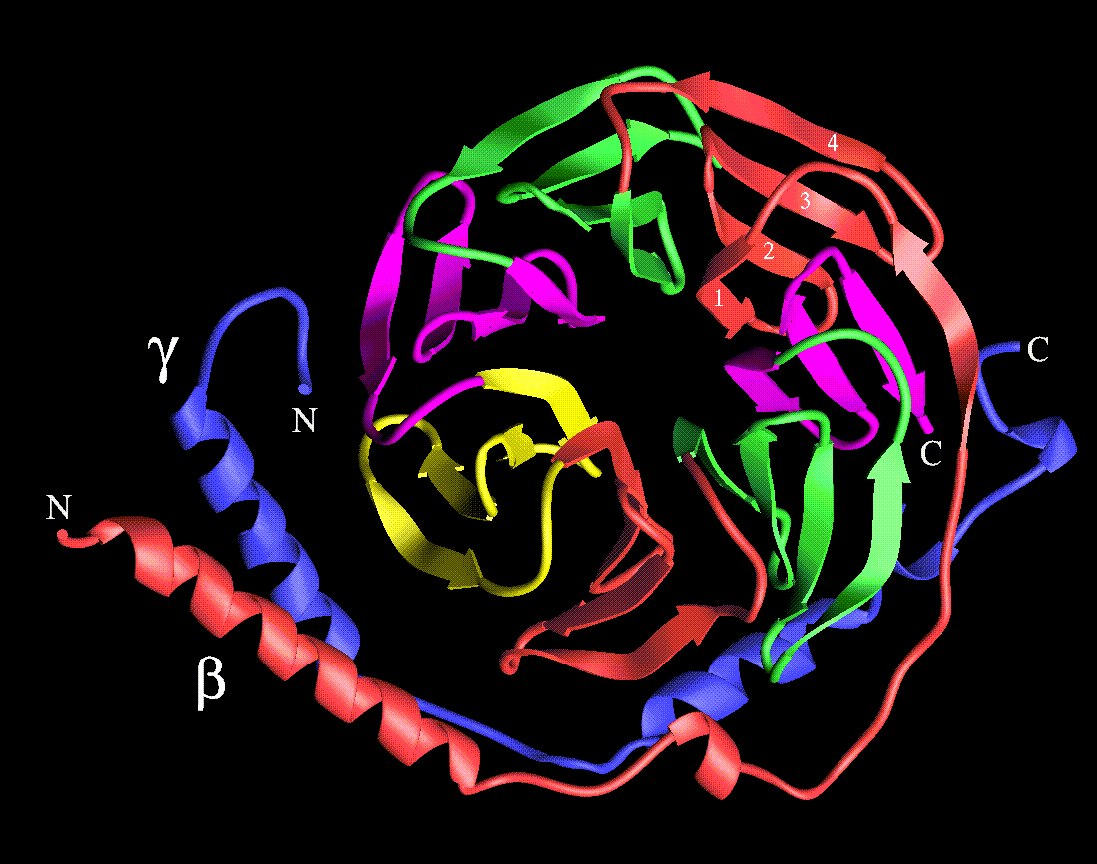
Figura 7. Representación, mediante cintas, de la estructura cristalina del complejo Tbg. Se muestra una visión desde el túnel central, ilustrándose con diversos colores las siete hojas constituyentes de la hélice propulsora b de Tb (Sondek et al., 1996).Tg. está coloreada de azul. Tomado de Hamm (1997).

En ese mismo año se publicó la estructura cristalográfica de la transducina heterotrimérica (Fig. 8), y una comparación de las estructuras de Ta y Tb g libres con la de la holoenzima, estableció las interacciones entre las subunidades, los cambios conformacionales que ocurren en cada subunidad para formar la interfase heterotrimérica, y reveló el mecanismo de liberación y activación inducido por GTP. Además, las estructuras tridimensionales revelaron que tanto la región N-terminal de Ta como la región C-terminal de Tg , las cuales poseen lípidos enlazados post-traduccionalmente, están muy cercanas espacialmente en el heterotrímero, localizándose sobre una cara común de la proteína. Esto sugiere que esta cara está orientada hacia la superficie de la membrana, y que dichos lípidos funcionan como sitios de unión de la transducina a la membrana.
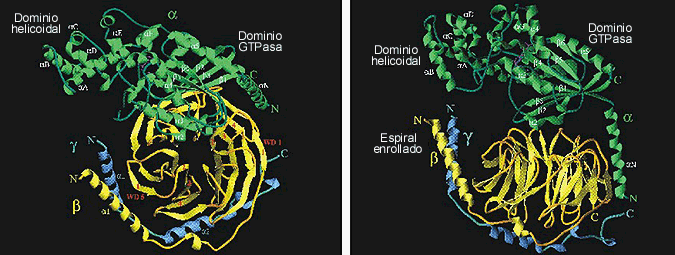
Figura 8. Estructura del complejo heterotrimérico de la transducina. Estructura cristalina de la transducina con Ta mostrada en verde, Tb en amarillo, Tg en azul, y el GDP en púrpura (Lambright et al., 1996.. Panel izquierdo: Representación, mediante cintas, del heterotrímero visto desde el eje de la hélice propulsora b de Tbg. Panel derecho: Representación, mediante cintas, del heterotrímero rotado 70º alrededor del eje horizontal, en referencia a la vista del panel izquierdo. Tomado de Hamm (1997).

Aunque una gran cantidad de información ha sido determinada a partir de estas estructuras cristalinas, siempre se hace necesario obtener evidencias químicas directas y consistentes para así fortalecer los resultados estructurales encontrados por cristalografía. En nuestro laboratorio hemos empleado herramientas de química de proteínas, para identificar residuos en la transducina que son funcionalmente importantes. |