Fisiología
Sistema Renina Angiotensina Renal: El papel de la Angiotensina 1-7 y la Enzima Convertidora de Angiotensina 2 en el riñón.
Angiotensina 1-7
La Ang 1-7, es un heptapéptido conocido desde la década de los 80, cuando estudios sobre el metabolismo de la Ang I marcada radioactivamente en homogenatos de tallo cerebral de perros, demuestran que el principal pico radiactivo en el efluente de la cromatografía líquida de alta presión, corresponde a este péptido; preservándose este pico, en muestras incubadas en presencia de un IECA y suprimiéndose la formación de Ang II radioactiva, indicando que la formación de la Ang 1-7 sigue una ruta independiente de la ECA [65]. Por mucho tiempo, se consideró a la Ang 1-7, como un producto inactivo del SRA [33]; sin embargo, este concepto comenzó a cambiar al final de los años 80 con los estudios de Schiavone y col [66], quienes demostraron que la Ang 1-7 era equipotente a la Ang II en liberar vasopresina in vivo y con los estudios de Campagnole – Santos y col [67], quienes reportaron que la administración de Ang 1-7 a nivel del núcleo del tracto solitario ocasionaba una disminución de la presión arterial en ratas; demostraron la importancia de la Ang 1-7 como un integrante biológicamente activo del SRA. La Ang 1-7 puede ser sintetizada a partir de la Ang I, Ang II o Ang 1-9 (Figura 2). La síntesis de la Ang 1-7 a partir de la Ang I requiere de alguna de las siguientes tres endopeptidasas tisulares denominadas neprilisina, prolil endopeptidasa y timet oligopeptidasa [68]. La conversión de Ang II en Ang 1-7 es catalizada por la prolilcarboxipeptidasa (angiotensinasa C) y por la prolil endopeptidasa [69]. Por su parte, la obtención de Ang 1-7 a partir de Ang 1-9, es mediada por la neprisilina y por la ECA. Asimismo, la Ang 1-7 se puede formar por la acción de ECA-2 a partir de la Ang II o de la Ang I [36]; siendo la conversión de la Ang II a la Ang 1-7 la vía preferida, con una eficiencia 500 veces superior que desde la Ang I. 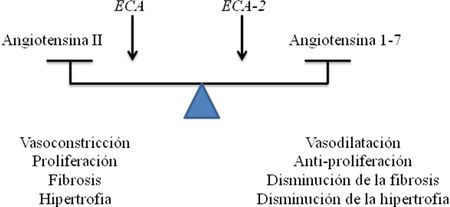 Figura 3 Figura 3. Relación ECA/ECA-2. Dependiendo del balance ECA/ECA-2, se obtendrá los efectos de la Ang 1-7 o Ang II; ya que si la relación ECA/ECA-2 es alta, se tendrá mayores niveles de Ang II que de Ang 1-7, observándose vasoconstricción, proliferación, fibrosis, hipertrofia; por su parte, si la relación ECA/ECA-2 es baja, se favorece la formación de Ang 1-7, y predominarán sus efectos, como la vasodilatación, anti proliferación. ECA: Enzima Convertidora de Angiotensina. ECA-2: Enzima Convertidora de Angiotensina - 2 (Tomado de Ferrario CM. y col., 1997 2006) [68] Para el año 2000, todavía no estaba del todo entendido, el conocimiento sobre el o los tipos de receptores a través de los cuales la Ang 1-7 ejerce sus acciones; sin embargo, debido a que algunos de los efectos de la Ang 1-7 podían ser bloqueados con inhibidores selectivos de estos receptores, se sabía que la Ang 1-7 podía ejercer algunas de sus acciones, al interactuar con los receptores AT1 y AT2. Sin embargo, la baja afinidad de la Ang 1-7 por los receptores AT1 y AT2 [70], así como la existencia de efectos de la Ang 1-7, que no eran bloqueados por los antagonistas de los receptores AT1 y AT2 (como el antidiurético), llevaron a plantear la existencia de un receptor selectivo para la Ang 1-7. En el año 2003, Santos y col [71], utilizando los riñones de ratones mostraron que la supresión genética del receptor Mas elimina la unión de la Ang 1-7; y ocasiona la pérdida de la acción antidiurética de la misma después de la carga aguda de agua (Figura 4); demostrando que la Ang 1-7 es el ligando endógeno del receptor Mas, un receptor de siete dominios transmembrana acoplado a proteína G, inicialmente descrito como un receptor huérfano [72]. El receptor Mas es codificado por el protooncogen Mas, el cual se detectó y caracterizó por sus propiedades tumorigénicas in vivo [73]. El ARN de este receptor, se expresa en diversos tejidos como testículos, cerebro, corazón, riñón; demostrándose su presencia en las células del túbulo contorneado proximal [32], donde también se encuentran localizados la ECA-2 y la Ang 1-7; evidenciándose una correspondencia entre la ubicación del ligando y de su receptor a este nivel. En cuanto a la vía de señalización del receptor Mas, todavía no está completamente señalada; sin embargo se ha encontrado que la Ang 1-7 a través de este receptor puede inhibir la fosforilación de las MAPKs, y puede suprimir el incremento del factor crecimiento transformante β inducido por la Ang II [32,74, 75]. Por otra parte, la Ang 1-7 estimula la producción de ácido araquidónico en las células musculares lisas de aorta de conejos, cerdos y ratas, y participa en la formación de la prostaglandina I2 (PGI2), mediante la acción de la ciclooxigenasa y la fosfolipasa A2 [76]. 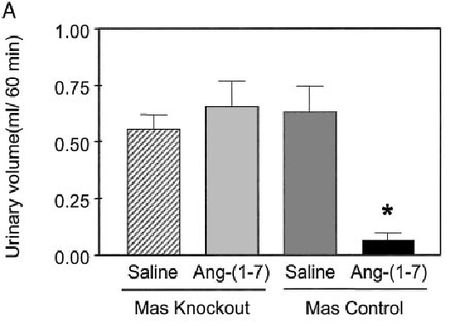 Figura 4. Figura 4. Efecto antidiurético de la Ang 1-7 en ratones con carga de agua. Se observa el efecto antidiurético de la Ang 1-7 tras la administración de 4 pmol /10 g de Ang 1-7 por vía intraperitoneal en ratones macho Mas controles, quienes recibieron carga de agua; por su parte, los ratones deficientes del receptor Mas, pierden la capacidad de respuesta a la acción antidiurética de la Ang 1-7. Resultados presentados como media + desviación estándar. * p<0,05, comparado con los ratones tratados con vehículo (Tomado de Santos y col., 2003) [71] Asimismo, la Ang 1-7 a través del receptor Mas, incrementa la producción de óxido nítrico (NO), al activar la sintasa de óxido nítrico endotelial, a través de un mecanismo que involucra la fosforilación de la Ser 1777 y la defosforilación de la Thr 495, lo cual lleva a la activación de la vía fosfatidil inositol 3 kinasa (PIK3-AKT) [77]. Por otra parte, se ha demostrado que la Ang 1-7 interfiere con la entrada de Ca++ extracelular en células de músculo liso [78] e inhibe la actividad de la tirosina kinasa en la pituitaria anterior de ratas [79]. La Ang 1-7 cumple diversos efectos a nivel cardíaco, renal y sistémico; los cuales generalmente son opuestos a los inducidos por la Ang II, ya que promueve la vasodilatación, que es mediada por la liberación de NO y PGI2, y por la potenciación de la acción de la bradikinina [80,81]; debido a la interacción entre el SRA y la bradiquinina (la cual puede ser de dos tipos), la potenciación de la acción de la bradikinina por la Ang 1-7, y la mediación de la acción vascular de la Ang 1-7 por parte de las kininas, lo cual resulta en vasodilatación [82] . Asimismo, la Ang 1-7 promueve la inhibición del crecimiento de las células vasculares. A nivel cardíaco, la Ang 1-7 ha demostrado ser cardioprotectora, debido a que reduce o previene la fibrosis a este nivel [58,59,83,84], además tiene acción antiarritmogénica, antitrombótica, y de antiproliferación celular [85-88]. Por lo tanto, la mayoría de las acciones de la Ang 1-7 son opuestas a las de la Ang II, por lo que contra - regula la vasoconstricción, la acción arritmogénica, protrombótica y proliferativa inducida por la Ang II [89,90]. Es bien conocido que los riñones son el principal órgano blanco de la acción de la Ang 1-7 [91]; a pesar de ello, en este órgano el papel de este péptido no está completamente establecido, pero se conoce que está involucrado en la regulación del balance electrolítico, así como en la regulación de la presión arterial [25], estos efectos están relacionados con la modulación de la excreción renal de sodio, tanto en los segmentos de los túbulos proximal y distal de la nefrona [26], y en parte a la regulación de la reabsorción transcelular de sodio [25,27,92,93]. La reabsorción transcelular de sodio en el túbulo proximal, involucra dos tipos de transportadores activos primarios, la bomba Na+/K+ ATPasa sensible a ouabaína y la bomba Na+ - ATPasa insensible a ouabaina, sensible a furosemida [94,95]. Estas bombas están ubicadas a nivel basolateral, y están involucradas en la génesis del gradiente electroquímico de sodio [96]. Los efectos de la Ang 1-7 a nivel renal son un tanto confusos y contradictorios; ya que algunos estudios indican la acción diurética y natriurética de este péptido en ratas [25,91], y otros estudios en ratas y ratones con carga de agua, señalan su acción antidiurética, al estimular la liberación de arginina – vasopresina y reducir la tasa de filtración glomerular; sugiriendo una posible interacción entre el receptor Mas, AT1, AT2 y el receptor arginina-vasopresina [96,97]. Por otra parte, también se han encontrado datos contradictorios, en cuanto a la natriuresis , pues en estudios con animales anestesiados euvolémicos, la Ang 1-7 promueve la natriuresis [25,97]; por su parte, en ratas no anestesiadas la Ang 1-7 no produce el mismo efecto [25,98]. Sin embargo, estos datos discordantes en cuanto a la excreción renal de sodio y agua, pueden ser debido, al efecto bifásico que ha demostrado tener la Ang 1-7 sobre el transporte de agua y bicarbonato a nivel del túbulo proximal; ya que a bajas concentraciones (1 pM), la Ang 1-7, estimula la reabsorción de bicarbonato y agua; por otro lado, altas concentraciones (10 nM), inhiben la reabsorción, asociándose dicho efecto a la modulación del intercambiador Na+/H+ [99]. También, se ha demostrado que la Ang 1-7 tiene un efecto bifásico sobre la actividad de la bomba Na+-ATPasa, involucrada en la reabsorción de Na+ a nivel del túbulo proximal; donde, concentraciones de 1nM de Na+, estimulan al máximo la actividad de la enzima y concentraciones superiores a éstas, ocasionan disminución de su actividad; sin embargo, la Ang 1-7 puede ayudar a contrarrestar la acción de la Ang II; ya que la Ang 1-7 revierte progresivamente la estimulación de la actividad de la Na+-ATPasa inducida por la Ang II; indicando su papel como regulador de la reabsorción de Na+ según las condiciones fisiológicas; ya que bajo condiciones donde la Ang II promueve la reabsorción máxima de Na+ en el túbulo proximal, la Ang 1-7 puede regular hacia la baja este proceso, conllevando a una fina regulación de la excreción de Na+ [26]; en este sentido, la Ang 1-7 puede funcionar como un agonista o antagonista de la Ang II sobre la actividad de la bomba Na+-ATPasa, dependiendo de su concentración; lo cual representa un importante mecanismo de regulación del volumen extracelular [4]. Del mismo modo, hallazgos recientes, han mostrado que la inhibición, de la actividad de la bomba Na+-ATPasa de los túbulos proximal de la corteza externa renal, por la Ang 1-7 (Figura 5), es mediada por el receptor AT2, mediante la activación de una proteína Gi/0, con la consecuente activación de la vía GMPc / PKG [100]; por su parte, en los túbulos proximal de la corteza interna renal, la inhibición de la actividad de la bomba Na+-ATPasa por la Ang 1-7 mediada por los receptores AT2, es por la activación de la vía Gs/AMPc/Proteína Kinasa A (PKAA) [101], por lo tanto estos hallazgos indican a nivel renal que, a pesar de la baja expresión de los receptores AT2 (en comparación a los AT1), éstos cumplen una importante función en la regulación hidroelectrolítica, y que la vía de señalización acoplada al receptor AT2, puede depender del tipo celular y de su ubicación a nivel renal. Por otra parte, la Ang 1-7 provoca vasodilatación de la arteriola aferente renal, de manera independiente de los receptores AT1 y AT2; debido a que aumenta la liberación de NO, lo cual indica que la Ang 1-7 juega una importante función en la regulación hemodinámica renal [102]; de igual manera, como se mencionó anteriormente, la Ang 1-7 puede ayudar a contrarrestar los efectos de la Ang II generada en el túbulo proximal, ayudando a proteger al riñón contra el desarrollo y progresión de fibrosis tubulointersticial; ya que suprime el incremento del factor crecimiento transformante β inducido por la Ang II [32]. Estos antecedentes indican que la Ang 1-7 es renoprotectora; por lo tanto el empleo de agonistas del receptor Mas en modelos animales, ha demostrado tener utilidad a nivel renal; ya que la administración de 24 µg/Kg de Ang 1-7, durante 4 semanas por vía intraperitoneal en ratas espontáneamente hipertensas tratadas crónicamente con el inhibidor de la síntesis de óxido nítrico L-NAME (80 mg/L durante 4 semanas), demostró mejorar la función renal, ya que disminuye la proteinuria y la presión arterial comparado con los animales hipertensos no tratados con la Ang 1-7. Asimismo, este heptapéptido mostró mejorar los cambios histológicos observados en las arteriolas glomerulares de estas ratas, ya que los animales tratados con Ang 1-7 mostraron un moderado engrosamiento de la capa media de las arteriolas glomerulares; por su parte las ratas no tratadas evidenciaron necrosis fibrinoide de la pared arteriolar glomerular con o sin cambios escleróticos. De igual manera el agonista no peptídico del receptor Mas, AVE 0991 (24 µg/Kg) mostró los mismos efectos beneficiosos sobre la función renal, que los mostrados por la Ang 1-7 [103]. Por lo tanto, el tratamiento con agonistas del receptor Mas, demostró tener efectos favorables a nivel renal, por lo que estas moléculas podrían constituir una potencial alternativa terapéutica, en el manejo de la nefropatía en hipertensos. Metabolismo de la Ang 1-7 Una vez que la Ang 1-7 es sintetizada, ésta es metabolizada por diferentes enzimas. Las enzimas involucradas en el metabolismo de la Ang 1-7, incluye las aminopeptidasas, neprisilina y a la ECA. La aminopeptidasa, produce Ang 2-7 y 3-7, al hidrolizar el aminoácido N- terminal (Asp), o el dipéptido N- terminal (Asp-Arg) de la Ang 1-7. Por otra parte, la ECA hidroliza el enlace Ile-His, produciendo el pentapéptido Ang 1-5 y un dipéptido [47]. La neprisilina, ha mostrado hidrolizar a la Ang 1-7 entre el residuo Tyr 4-Ile 5, dando lugar a Ang 1-4 y el tripéptido Ile-His-Pro [104]. A nivel renal, el metabolismo de la Ang 1-7 ha sido estudiado por diferentes grupos de investigadores; demostrando que la neprisilina, es la principal enzima encargada del metabolismo de este péptido a nivel renal [104]. De hecho, en el año 2000, Allred y col [105] estudiaron el metabolismo de este péptido, empleando preparaciones del borde en cepillo de la corteza renal de ratas; sus resultados revelaron que el empleo de inhibidores de la neprisilina (SCH 39370) conllevaron a un incremento en las concentraciones de Ang 1-7, debido a su menor metabolismo; sin embargo, el bloqueo de esta enzima, no elimina el metabolismo de la Ang 1-7, pero incrementa su tiempo de vida media. Asimismo, las acciones renales de los inhibidores de la neprisilina, son atribuidos a la preservación de la bradikinina, o del péptido natriurético; así como de la protección de la degradación de la Ang 1-7 [106,107]. 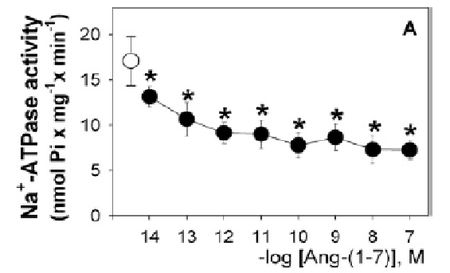 Figura 5 Figura 5.- Inhibición de la actividad de la Na+-ATPasa por la Ang 1-7. Se observa una disminución de la actividad de la bomba, dosis dependiente (Círculos rellenos). Actividad de la bomba Na+-ATPasa en ausencia de Ang 1-7 (Círculo vacío). Los resultados son expresados como la media + desviación estándar. * p<0,05, comparado con el control (Tomado de Lara L., 2006) [100] De igual manera, estudios en humanos han revelado que a nivel renal, la neprisilina juega un papel fundamental en el metabolismo de la Ang 1-7, ya que en pacientes hipertensos, el omapatrilat, un inhibidor de la neprisilina y ECA, incrementó la concentración sérica de Ang 1-7 y disminuyó la presión arterial de los mismos [108],demostrando que el abordaje farmacológico del metabolismo de la Ang 1-7, puede ser una estrategia eficaz para el tratamiento de la hipertensión arterial; ya que la Ang 1-7 permanecería por más tiempo para ejercer sus efectos. |