Parasitología
Efectos moduladores de las parasitosis helmínticas en el desarrollo del asma y las enfermedades alérgicas
Efecto supresor de las parasitosis helmínticas en el desarrollo de las enfermedades
Distintos grupos de investigadores han planteado que en comunidades rurales de países en vías de desarrollo donde las parasitosis intestinales son endémicas y crónicas, existe una relación inversa entre reactividad alérgica y la prevalencia de estos parásitos (21, 46).
Estudios iniciales de nuestro grupo en individuos provenientes de distintos niveles socio-económicos, han demostrado una asociación entre la prevalencia de parasitosis helmínticas y la frecuencia de asma y alergias (47).
En poblaciones con una alta prevalencia de infecciones helmínticas se observa bloqueo dela reactividad alérgica y disminución de la expresión de los síntomas de alergia al ser comparadas con poblaciones de un nivel socio-económico medio-alto donde la infección por estos parísitos es esporádica o menos frecuente (36).
Existen evidencias de que estos parísitos desarrollan mecanismos de evasión de la respuesta inmune establecida por el hospedador, evitan así el desencadenamiento de reacciones de hipersensibilidad inmediata locales que crearían un ambiente inhóspito para el establecimiento de las larvas en el intestino.
Se han planteado diversas hipótesis para explicar estos mecanismos de evasión. Los helmintos pueden estimular la producción de IgE de manera inespecífica y policlonal. Trabajos de diversos autores demuestran que en poblaciones humanas donde las parasitosis helmínticas son endémicas, los niveles de IgE sérica total son extremadamente elevados y no correlacionan con la respuesta específica efectora contra el parásito.
Estos altos niveles de IgE pueden suprimir la respuesta alérgica mediante un mecanismo funcional a través de la saturación de los receptores de los mastocitos y basífilos, que evita la respuesta inflamatoria que conduce a la expulsión de las larvas.
En Venezuela, comprobamos a través de estudios epidemiológicos de poblaciones de bajos recursos- el efecto supresor de estas parasitosis mediante pruebas de hipersensibilidad cutánea frente a distintos aeroalergenos y encontramos además una fuerte correlación inversa entre los niveles de IgE total y la positividad cutánea frente a aeroalergenos y a la positividad de la prueba de Praustnitz Kustner, indicando que la saturación mastocitaria podría estar asociada a la baja reactividad alérgica (37).
Otro mecanismo que inhibe la reactividad alérgica en los individuos altamente parasitados es la dificultad que exhiben para responder con niveles adecuados de IgE específica contra el parísito y frente a otros antígenos ambientales (26).
Estudios experimentales más recientes indican que los helmintos estimulan las cálulas T CD4+CD25+, productoras de IL-10 y TGFβ, capaces de inhibir la respuesta inflamatoria protectora, lo que favorece la persistencia de la infección. Trabajos en ratones parasitados con Heligosomoides polygyrus muestran que el efecto de estimulación de las vías respiratorias inducido por antígenos parasitarios es suprimido por un mecanismo dependiente de IL-10. Otros trabajos en humanos han confirmado estos resultados (48).
Este efecto protector puede ser revertido utilizando un tratamiento con anticuerpos anti CD25+, inactivando así la producción de citocinas supresoras (49).
Trabajos recientes en nuestro laboratorio demuestran que niños provenientes de comunidades indígenas en alto riesgo de infección, mostraron una relación inversa de IL -10 y de IgE específica anti-Ascaris. (Tabla 3).
Tabla 3. Parámetros inmunológicos asociados a la infección por A.lumbricoides en niños venezolanos de la etnia Warao, de acuerdo a la presencia de hiper-reactividad bronquial
|
*p<0.05
**p<0.01 |
Con hiper-reactividad bronquial(n= 37) |
Sin hiper-reactividad bronquial (n= 128) |
|
IL-10 pg/ml
(x ? DS) |
95±76* |
185±110 |
|
% de positividad en pruebas de hipersensibilidad frente a D. pteronyssinus |
6 |
8 |
|
% de positividad en pruebas de hipersensibilidad frente a A. lumbricoides |
46,8* |
27,5 |
|
Niveles séricos de IgE anti-D. pteronyssinus
(x ± DS) |
0,450 ± 0,22 |
0,36 ± 0,18 |
|
Niveles séricos de IgE anti-A. lumbricoides
(x ± DS) |
4,750 ± 2,914** |
1,75 ± 0,66 |
|
Huevos de A.lumbricoides/gr heces.
(xg + 1 DS) |
3370
(7637) |
2572
(4752) |
Además de la carga parasitaria, otros factores relacionados con la pobreza como malnutrición, afectan la producción de IgE específica y el desarrollo de alergias y asma en poblaciones socio-económicamente desfavorecidas (39). En niños clínicamente desnutridos se ha demostrado una disminución en la capacidad de establecer respuestas de linfocitos T memoria CD4+CD45 RO+ (50)
Por otra parte, las infecciones virales y bacterianas y las producidas por protozoarios, podrían estimular la producción de citocinas reguladoras (3). Por lo tanto, otros factores asociados al riesgo continuo de infecciones en niños provenientes de comunidades en estado de extrema pobreza podrían influir en la baja reactividad alérgica descrita en estos grupos humanos. De hecho, en Venezuela hemos encontrado una estrecha asociación entre los niveles de pobreza, la disminución de la reactividad alérgica y la baja frecuencia de enfermedades atópicas (51). Las bajas condiciones higiónicas, falta de agua potable y mala disposición de excretas se asocian frecuentemente con la disminución de la reactividad alérgica (52). Similarmente, en un amplio estudio realizado en Ecuador se encontró que entre los factores que influían en disminuir la reactividad alérgica eran la falta de agua potable, una disposición inadecuada de excretas y el hacinamiento independientemente de la carga parasitaria (53).
En resumen, el análisis de la información derivada de diversos trabajos experimentales y de distintos grupos poblacionales, indica que el papel modulador de los helmintos depende de la prevalencia, intensidad y posiblemente la cronicidad de estas infecciones.
En condiciones en donde las parasitosis están presentes pero en una forma esporádica y leve, la reactividad alérgica parece ser elevada debido posiblemente a la respuesta inflamatoria específica desarrollada frente a antígenos del parísito y, por otra parte, a la potenciación no específica de la síntesis de IgE contra alergenos ambientales. En cambio, cuando la infección por parásitos es crónica e intensa, la sobre-estimulación del sistema IgE resultaría en un efecto inhibidor de la reactividad alérgica, debido a la saturación de los receptores de los mastocitos y a la posible inhibición de la síntesis de IgE específica.
Por otra parte, algunos mediadores parasitarios pueden estimular también la síntesis de citoquinas reguladoras, inhibiendo así la función mastocitaria que promueve la reactividad alérgica. Existe un punto en el cual los efectos estimulantes de la infección parasitaria pudieran estar contrarrestados por señales inhibitorias y así la reactividad alérgica sería equivalente a la encontrada en los individuos no infectados. Más allí de este punto, con una carga parasitaria alta la supresión predominaría produciendo una reactividad extremadamente baja aún con una alta sensibilización a los ácaros del polvo de casa o a algún otro alergeno ambiental (Figura 1).
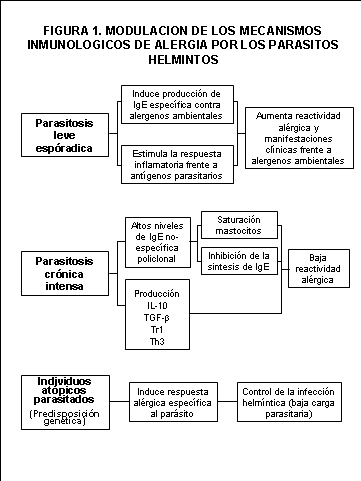
Todas estas reflexiones nos llevan a pensar que la asociación entre alergia e infecciones, particularmente las infecciones helmínticas, es compleja. Cada población, con sus características ambientales propias, predisposición genética y experiencia inmunológica, determina una relación distinta, por lo que la posibilidad de establecer una hipótesis general está limitada debido a la dinámica real del fenómeno en las distintas zonas del globo terráqueo. |