Una vez que ocurre la unión
a la insulina al IR el mismo se autofosforila en tres sitios en asa activadora
(Y1158; Y1162 y Y1163) sin embargo las mismas no son responsables por la
interacción con las proteínas con dominios
SH2 (homologías Src 2) o dominios de unión a fosfotirosina (PTB por sus
siglas en inglés) que funcionan como substratos del receptor, por el contrario
las mismas se unen a la tirosina fosforilada Y972 de la región yuxtamembranosa
colocándolas en posición para su fosforilación y activación por el asa
activadora. Estos substratos son: una familia de proteínas substratos del
receptor de la insulina (IRS por sus siglas en inglés) en la cual existen 6
miembros y las proteínas adaptadoras Shc (proteínas con dominios de homología
Src 2)(7) .
Para comprender mejor la
transducción intracelular de la señalización de la insulina es adecuado
postular la existencia de tres “nódulos críticos” a saber: el IR e IRS, la
fosfatidilinositol 3 quinasa (PI3K por sus siglas en inglés) y la proteína
quinasa B (AKT/PKB por sus siglas en inglés)(20). Las
características del IR fueron descritas en la sección precedente.
De las 6 proteínas IRS las 5
y 6 no tienen actividad de substratos de IR(21), de las cuatro
restantes IRS 1 y 2 son las más importantes y alcanzan una distribución ubicua,
IRS3 se encuentra en los adipocitos y el cerebro mientas que IRS4 se encuentra
en las células embrionarias. IRS 1 y 2 y
las proteínas adaptadoras Shc median efectos metabólicos de la insulina(20).
Los IRS son proteínas que poseen en el extremo amino terminal un dominio de
homología de pleckstrina (es un dominio de unos 120 aminoácidos que existe en
una gama de proteínas relacionadas con la señalización intracelular y el
citoesqueleto y tienen la capacidad de unirse a los fosfolípidos de la membrana
plasmática) adyacente a un dominio de
PTB el cual une a la tirosina fosforilada Y972 de la porción yuxtamembranosa
del dominio citoplasmático de IR. Las regiones centrales y carboxilo terminales
de las proteínas IRS poseen unas 20 tirosinas potencialmente fosforilables por
el IR fosforilado. Luego de activados, por fosforilación, los IRS unen moléculas que contienen dominios
SH2.
Del “nódulo” IR-IRS parten
dos vías principales de señalización de la insulina, estas son: la vía de la
PI3K (una quinasa de fosfolípidos)/AKT (PKB)(22) y la vía de Raf/Ras/MEK/ MAPK (proteína
quinasa activado por mitógeno también conocida como quinasa regulada por
señales extracelulares, ERK por sus siglas en inglés) (23). La vía
de la PI3K es responsable de la mayoría de los efectos metabólicos de la
insulina y está conectado exclusivamente a IRS, por otro lado, la vía de la
MAPK parte de ambos IRS y Shc y está relacionada con la regulación de la
expresión genética y con la cooperación entre PI3K y el control del crecimiento
(mitogéneis) y diferenciación celular(20).
Vía de la Fosfatidilinositol
3 quinasa.
La activación de la vía de
la PI3K, se inicia con la unión de los 2 dominios de SH2 presentes en la
subunidad regulatoria (p85) de la enzima a los IRS 1 y/o 2 fosforilados por IR,
con lo cual se activa la subunidad catalítica (p110) la cual fosforila al
fosfatidilinositol 4; 5 bisfosfato generando
fosfatidilinositol-3; 4; 5 trifosfato (PIP3), este fosfolípido actúa
como segundo mensajero, se une por medio
de un dominio de homología de pleckstrina a la proteína quinasa dependiente de
fosfoinositol (PDK por sus siglas en inglés) activándola. Por su parte PDK fosforila y
activa a AKT/PBK (20) (Figura 2).
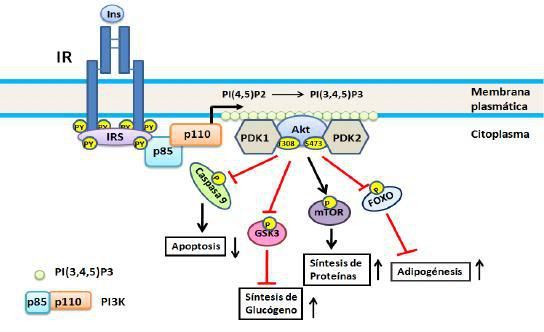
Figura
2. Vía de PI3K. Se
inicia por la unión de la subunidad reguladora (p85) de la PI3K a los IRS
fosforilados con lo cual se activa la subunidad catalítica (110), esta a su vez
fosforila a PIP2 transformándolo en PIP3, este último
actuando como segundo mensajero activa a PDK la cual fosforila a AKT/PBK. En el
esquema se representan cuatro de los substratos de AKT/PBK: caspasa 9, GSK3,
mTOR y Fox0; no se incluye AS160 ya que ésta será objeto de consideración
aparte. Para detalles ver el texto.
AKT/PBK, son una familia de
proteína quinasas de serina/treonina que poseen un dominio de homología de
pleckstrina lo cual permite su reclutamiento a la membrana plasmática para
unirse a PIP3. Los substratos más importantes del “nódulo” AKT/PBK son:
- El blanco de la rapamicina
en los mamíferos (mTOR por sus siglas en inglés) involucrada en la regulación
de la síntesis de proteínas (24). mTOR es una proteína quinasa de
serina/treonina que actúa como sensor de nutrientes y que funciona como la
subunidad catalítica de 2 complejos estructuralmente distintos mTORC1 y mTORC2.
mTOR estimula la síntesis de proteínas por fosforilación del factor de
iniciación eucariota E4 que une a la proteína 1 y por fosforilación de la
proteína ribosomal p70 S6 quinasa (24).
- La quinasa 3 de la
glucógeno sintasa (GSK3 por sus siglas en inglés) involucrada en la regulación
de la síntesis de glucógeno 25. La GSK3 es una quinasa de
serina/treonina que inhibe por fosforilación a la glucógeno sintasa. La GSK3 es
inhibida por fosforilación por AKT/PKB con lo cual se estimula la síntesis de
glucógeno.
- La familia 0 de los
factores de transcripción “cabeza de tenedores” (Fox0 por sus siglas en inglés)
y en particular Fox01 el cual está involucrado en la regulación de los genes
gluconegénicos y adipogénicos (26). Fox01 es un factor de transcripción que en
ausencia de insulina se traslada al núcleo y estimula la expresión de genes
tales como el de la fosfoenol piruvato carboxiquinasa, una enzima clave en la
neoglucogenésis, así como el de la ciclina atípica G2 la cual bloquea el ciclo
celular, Fox01 es inhibido por la
insulina y aparentemente juega un papel muy importante en la mitogénesis
inducida por insulina (27). Fox01 es secuestrado en el citoplasma por
la fosforilación por AKT/PKB y en consecuencia no estimula la transcripción de los
genes antes citados.
- La proteína AS160
(substrato de AKT/PKB de 160 KDa) involucrada en el transporte de glucosa(28),
en vista del papel muy importante que juega en la homeostasis de glucosa será
discutido con algún detalle más adelante.
- Fosforila y activa a la
enzima sintasa de óxido nítrico endotelial (eNOS por sus siglas en inglés) la
cual produce la molécula vasodilatadora y anti-inflamatoria óxido nítrico (NO)
estableciéndose una conexión potencial entre la resistencia a la insulina y las
enfermedades cardiovasculares (29).
- Fosforila directamente la proteínas
caspasa 9, inhibiendo su actividad apoptótica у promoviendo por tanto la
supervivencia celular.
Vía de Raf/Ras/MEK/ MAPK.
Una segunda rama esencial de
la señalización de la insulina la constituye la vía de Raf/Ras/MEK/ MAPK
(Figura 3), la cual es independiente de PI3K y de AKT/PKB. Ambos, IR activado y
las proteínas IRS activadas poseen sitios de unión a proteínas que contienen
dominios SH2 tales como Grb2 (proteína adaptadora que une al factor de
crecimiento 2, está relacionada con la transducción de señales celulares) y Shc
(Son 3 proteínas de PM 46; 52 y 66KDal que poseen en el extremo amino terminal dominios de unión
a fosfotirosina, PBT, y en el extremo
carboxilo terminal dominios SH2). El extremo carboxilo terminal de Grb2 une
proteínas como Gab-1 (es uno de los substratos de las proteínas IRS) y en el
extremo amino terminal une proteínas ricas en prolina tales como “hijo de los
sin siete” (SOS por sus siglas en inglés) la cual funciona como un
intercambiador de nucleótidos de guanina para Ras (proteínas de bajo peso
molecular que unen nucleótidos de guanina, controlan diferentes fenómenos:
integridad del citoesqueleto; proliferación, diferenciación, adhesión y migración
celular y la apoptosis). SOS permiten la conversión de Ras asociado a la
membrana plasmática de la forma inactiva unido a GDP a la forma activa unido a
GTP. Ras-GTP activa a la proteína quinasa de serina/treonina denominada Raf, la
cual estimula por fosforilación, en serina/treonina, su blanco corriente abajo
MEK1 y 2 (este acrónimo deriva de MAP
quinasa, ERK y Kinasa), estos a su vez
fosforilan (en serina/treonina) y activan a las MAP quinasas (proteína quinasa
activada por mitógeno) la cual activa por fosforilación a ERK1 y 2 (quinasa
regulada por señal extracelular). La activación de ERK1 y 2 juega un papel
directo en la proliferación y diferenciación celular regulando la expresión de
genes y eventos extranucleares tales como la organización del citoesqueleto
mediante la fosforilación y activación de blancos en el núcleo y el citoplasma (23).
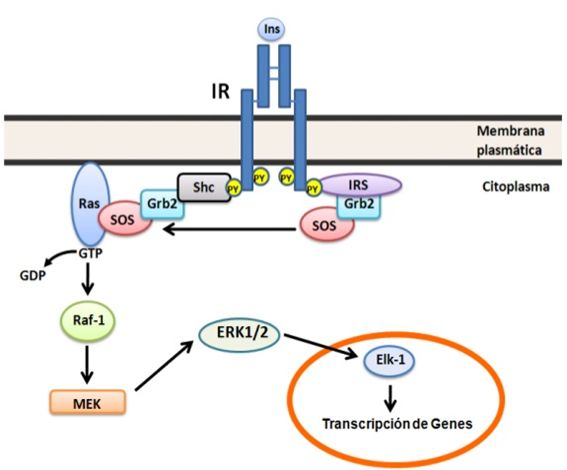
Figura 3. Vía de Raf/Ras/MEK/ MAPK. Esta vía se inicia con la interacción de IR e
IRS activados con las proteínas adaptadoras Grb2 y Shc, ésta última une SOS que
actúa como un intercambiador de nucleótidos de guanina en la proteína de bajo
peso molecular Ras. Ras-GTP fosforila y activa a la proteína quinasa Raf, ésta
a vez fosforila a MEK, la cual activa por fosforilación a ERK 1 y 2 que
modifican eventos nucleares y citoplasmáticos. Para detalles ver el texto.Translocación del GLUT 4 regulado por la insulina.
El efecto clásico de la
acción de la insulita es la entrada de la glucosa a las células del tejido
adiposo, al músculo esquelético y cardiaco(2). La entrada de
glucosa al músculo esquelético es el evento más importante mediado por la
insulina que previene la hiperglicemia postprandial; éste ocurre gracias a la
translocación, desde vesículas intracelulares a la membrana plasmática, del
transportador de glucosa 4 (GLUT4) por un mecanismo que aún no está
completamente claro(30).
El GLUT4 es una de las 13 isoformas de transportadores
de glucosa, los cuales poseen 12 dominios transmembranosos y que se expresa
abundantemente en los tejidos adiposo y muscular. Los GLUTs transportan
monosacáridos por un mecanismo independiente de ATP y sin el requerimiento de
sodio; el GLUT4 tiene la característica distintiva de encontrarse en vesículas
intracelulares (GSVs por sus siglas en inglés) en el estado no estimulado las
cuales son redistribuidas a la membrana plasmática por efectos de la insulina o
por otros estímulos como el ejercicio muscular (31).
En las células adiposas y
musculares, no estimuladas por la insulina, aproximadamente entre un 3-10 % de
los GLUT4 se encuentran en la membrana plasmática y más del 90 % está en
compartimientos intracelulares (GSV). La estimulación por insulina incrementa
considerablemente la exocitosis de GLUT4 a la membrana plasmática reduciendo
mínimamente la endocitosis(32). Concomitantemente ocurre una
redistribución de las GSV, de una forma cónica alrededor del núcleo a la de un
anillo(30). La fusión de las GSV a la membrana plasmática requiere
de unas proteínas de membrana asociadas a vesículas (VAMP2 por sus siglas en
inglés) las cuales pertenecen a la familia de las SNARE (proteínas que median
la fusión de vesículas a sus membranas blancos).
La principal vía involucrada
en la translocación de las GSVs es la PI3K – PDK – AKT/PBK, (Figura 4) ésta
última fosforila uno de sus substrato AS160 la cual es una proteína que modula la
actividad de GTPasa de la proteína de bajo peso molecular Rab. Cuando AS160 no
está fosforilado y es activa estimula la actividad de GTPasa de Rab generándose
Rab-GDP el cual es inactivo y se bloquea la exocitosis de GLUT4. Por el
contrario la fosforilación de AS160, por AKT/PBK, la inactiva con lo cual
predomina Rab-GTP incrementándose el tráfico de vesículas que contienen GLUT4 a
la membrana plasmática. En mutantes de AS160 se inhibe la translocación estimulada
por insulina de GLUT4(28) lo cual sugiere que funciona como un
regulador negativo que es inhibido por la insulina por medio de AKT/PBK. Así
mismo en ratones “knockdown” (que no
expresan una proteína) para AS160 se incrementa la cantidad basal de GLUT4 en
la membrana plasmática lo cual es consistente con la función de retención de
GLUT4 en GSVs intracelulares por AS160 que es liberado por la estimulación por
insulina (33).
La proteína quinasa C
atípica (aPKC por sus siglas en inglés) requiere de PIP3 y
fosforilación por PDK pero no está relacionada AKT/PKB; está involucrada en la
translocación de GLUT4 a la membrana plasmática y la captación de glucosa por
los tejidos adiposo y muscular 34. También se ha relacionado con la
regulación de la síntesis de lípidos en el hígado por incremento de la expresión
de la proteína que une el elemento regulador de los esteroles (35).
En los últimos años se ha
descrito una vía independiente de PI3K, que involucra CAP (proteína activada
por catabolíto la cual une AMPc) y APS (proteína adaptadora con dominios de pleckstrina
y SH2 y es substrato del IR) que interactúa con c-Cbl (proteína que une
ubiquitina, está relacionada con la señalización de ubiquitinización y
degradación de proteínas. Posee un dominio que une tirosina fosforilada) en la
translocación de GLUT4 y la captación de glucosa estimulada por la insulina
(Figura 4). Clb es fosforilado en tirosinas por IR y en consecuencia recluta
APS y CAP; posteriormente se une al complejo CrkII (proteínas adaptadoras que
unen varios tipos de proteínas fosforiladas en tirosina además de poseer
dominios SH2), esta a su vez interactúa con un factor liberador de nucleótidos
de guanina (C3G) el cual se comporta como un factor intercambiador de la
proteína de bajo peso molecular que une GTP, TC10 que activaría la aPKC (ζ/λ)
con el consecuente incremento de la translocación de GSV (36).
Finalmente la estimulación de CT10 afecta la dinámica de la actina y la
translocación de GLUT 4 a la membrana plasmática (36).
Se requiere de un
citoesqueleto con una actina dinámica para la translocación de GLUT4 a la
membrana plasmática y el incremento de la captación de glucosa (37),
en las células musculares la remodelación de los filamentos de actina requiere
de PI3K pero no de AKT/PBK(38). Se pudiera postular que la
remodelación de la actina promovida por la insulina provee de una plataforma
física para la migración de las
vesículas que contienen GLUT4 a la membrana plasmática, ayudada por
motores proteicos (39).
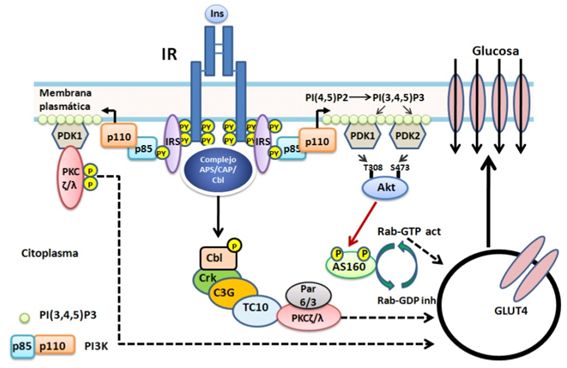
Figura
4. Exocitosis de GLUT4. La insulina promueve la translocación de
GLUT4 desde las GSV a la membrana plasmática. La proteína AS160 en su estado no
fosforilado y activo regula negativamente a la proteína G de bajo peso
molecular Rab las cuales participan en el tráfico de GSV. AS160 estimula la
hidrólisis de GTP generando Rab-GDP el cual es inactivo, inhibiendo el tráfico
de vesículas. Cuando AS160 es fosforilado por AKT/PBK se inhibe,
incrementándose Rab-GTP y se incrementa el tráfico de vesículas. Por otra parte
PDK fosforila la aPKC (ζ/λ) la cual incrementa la translocación de GSV. Se ha
postulado una vía alterna que parte de IR el cual activaría a las proteínas
APS-CAP-Cbl y estas activarían a la proteína G de bajo peso molecular TC10 que
activaría aPKC (ζ/λ) la cual incrementa la translocación de GSV.
El ejercicio muscular también
estimula la translocación del GLUT4 a la membrana plasmática través de un
mecanismo no mediado por la insulina y que no depende de PI3K, pero sí de la fosforilación de AS160 por la AMPK
(quinasa dependiente de AMP)(31), la cual funciona como un sensor
metabólico muy importante, se activa alostericamente por aumento de la
concentración intracelular de AMP (disminución concomitante de ATP) y por
fosforilación por quinasas como la proteína quinasa quinasa β dependiente de
calcio/calmodulina (40).