Monografías docentes
Glucagón y la hipótesis bihormonal de la diabetes
Receptor y señalización del glucagón
El receptor del glucagón (GcGR) es una proteína de 7 hélices transmembrana ubicada en la
superficie celular, está asociada a proteínas G (GPCR, por sus siglas en inglés) y se expresa
fundamentalmente en hígado, sin embargo, pequeñas cantidades se encuentran en riñón, tejido
adiposo, linfoblastos, bazo, páncreas, cerebro, glándula suprarrenal y tracto gastrointestinal30.
Es importante destacar que GcGR se expresa en las células α y β de los islotes pancreáticos31. La unión del glucagón a su receptor condiciona la activación de al menos 2 tipos de proteínas G,
(Figura 4) una de ellas relacionada con la producción de AMPc (Gαs
) y la otra, una proteína Gq
conectada con la vía de señalización del inositol 1; 4; 5 trifosfato (IP3, por sus siglas en inglés).
La activación de la proteína Gq conduce al incremento de actividad de la fosfolipasa C la cual
hidroliza al fosfatidil inositol 4; 5 bifosfato (PIP2, por sus siglas en inglés) para dar IP3 y
diacilglicérido, los cuales funcionan como segundos mensajeros. El IP3, por ser soluble en agua,
viaja por el citosol hasta el retículo endoplasmático donde abre los canales de Ca++
, el
incremento citosolíco de este ion activa la calcineurina la cual defosforila al coactivador 2 de la
transcripción regulado por la proteína que une al elemento que responde al AMPc (CRTC2,
también llamado TORC2, por sus siglas en inglés), que en esta condición puede migrar al núcleo
donde regula la transcripción (Figura 4) como discutiremos más adelante32. La activación de la proteína Gαs por el glucagón, estimula a la enzima adenilato ciclasa, (Figura
4) la cual a partir de ATP produce AMPc que se une a la subunidad reguladora de la proteína
quinasa A (PKA por sus siglas en inglés) quedando libre y activa la subunidad catalítica de dicha
enzima. La subunidad catalítica de PKA, fosforila y en consecuencia modifica la actividad de
enzimas claves del metabolismo de carbohidratos, como discutiremos más adelante. Además, la
subunidad catalítica de PKA, migra al núcleo donde fosforila a la proteína que une al elemento
que responde a AMPc (CREB, por sus siglas en inglés) el cual se une a las regiones promotoras
de algunos genes activando su expresión, tales como los de las enzimas neoglucogénicas:
fosfoenolpiruvato carboxiquinasa y glucosa-6-fosfatasa, así como el del coactivador 1α del
receptor activado de proliferación de peroxisomas (PGC1α)33. En condiciones de baja
concentración de ATP y en presencia de niveles altos de Ca++ y/o de AMPc se activa la
calcineurina la cual defosforila a CRTC2 que migra al núcleo donde incrementa los efectos de
CREB sobre la expresión de genes.33
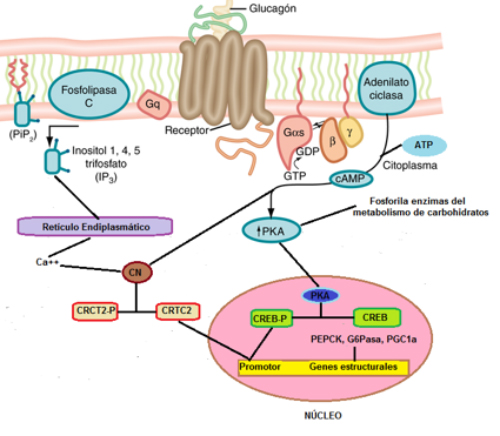 Figura 4. Señalización del glucagón. El receptor del glucagón, GcGR, es una proteína de 7
hélices transmembrana que se une a 2 tipos de proteínas G. Cuando la hormona se une a su
receptor activa a la proteína Gq la cual estimula a la fosfolipasa C que hidroliza al fosfatidil
inositol bifosfato (PIP2) produciendo inositol trifosfato (IP3) el cual activa la liberación de Ca++
del
retículo endoplasmático, el incremento de la concentración de dicho ion, activa a la cacineurina
(CN, que también puede ser activada por AMPc), que defosforila al coactivador 2 de la
transcripción regulado por la proteína que une al elemento que responde al AMPc (CRTC2), el
cual migra al núcleo donde regula la transcripción. La modulación del otro tipo de proteína G, la
Gαs, activa la enzima adenilato ciclasa la cual a partir de ATP sintetiza AMPc, el incremento de
éste último activa la proteína quinasa A (PKA) la cual fosforila varias enzimas del metabolismo
de carbohidratos, también migra al núcleo donde fosforila a la proteína que une al elemento que
responde a AMPc (CREB) que se une a las regiones promotoras de algunos genes activando su
expresión, tales como los de la fosfoenolpiruvato carboxiquinasa (PEPCK), glucosa-6-fosfatasa
(G6Pasa), coactivador 1α del receptor activado de proliferación de peroxisomas (PGC1α) entre
otros.
|