Dermatología
Estado actual de terapias CRISPR: nueva esperanza en elarmamento dermatológico
Avances en las vías de administración a la piel de terapias direccionadas por CRISPR
En general la
absorción de biomacromoléculas está muy restringida debido a su composición, ya
que la piel solo permite la absorción de moléculas pequeñas y moderadamente
lipofílicas, por lo que la administración de genes resulta desafiante. Otro
reto lo representa la falta de vasculatura en la epidermis y la estrecha zona
de unión epidérmica-dérmica que impiden el suministro o penetración de
biomacromoléculas. (3)
El sistema
CRISPR/Cas necesita estrategias de entrega in vitro, in vivo y ex vivo para
ejercer su función en el tratamiento de enfermedades, lo cual dependerá de las
propiedades de barrera de la piel, la carga genética, el alto peso molecular,
cargas negativas e inestabilidad biológica. Este sistema puede administrarse a
las células de tres formas diferentes (3):
ARNm + sgRNA:
Es una estrategia rápida pero el mRNA puede traducirse en el citoplasma. Con mala
estabilidad debido a su rápida degradación, lo que limita la duración de la
edición de genes. Presenta bajo efecto fue del objetivo. (2)
ADN plasmídico (pADN): Este codifica Cas9 y
sgRNA. Estabilidad alta, baja eficiencia ya que amerita ingreso al núcleo. (2)
Complejo de robonucleoproteína sgARN (RNP):
Alta eficiencia de edición, no requiere procesos de transcripción y traducción,
por lo que inicia la edición del genoma rápido y reduce efectos fuera del
objetivo, baja inmunogenicidad, difícil de empaquetar por el gran tamaño de la
enzima Cas9. (2)
Esto demuestra
que entregar el sistema CRISPR/Cas a su objetivo con alta eficacia y precisión
es complejo y difícil. Por ello se diseñaron métodos de entrega física, entrega
viral y entrega no viral. (2) (Figura 3)
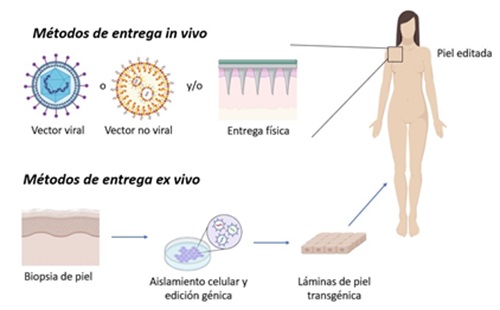
Figura 3. Métodos de entrega del sistema CRISPR/Cas (*) (*) Adaptado de Huang y col. (2022
Métodos de
entrega física: Los métodos físicos y disruptivos de barrera tienen
un gran potencial para la entrega de genes a la piel. (3)
Electroporación:
Es el método más ampliamente estudiado. Genera pulsos eléctricos de alta
intensidad (50-500 V) que produce una alteración del potencial eléctrico de la
membrana celular creando transitoriamente poros acuosos en las bicapas
lipídicas del estrato córneo lo que facilita la entrada de biomacromoléculas,
como ARN/ADN o CRIPSR/Cas por el impulso eléctrico, con posterior reparación de
la membrana. Dentro de sus desventajas se incluyen la muerte celular por
cambios de pH. (2)(3)(19)
Iontoforesis:
Implica la aplicación de corrientes eléctricas fisiológicamente aceptables
(0,1-1,0 mA/cm2) para conducir fármacos iónicos a través de la piel a favor del
gradiente de potencial y concentración. (19)
Sonoporación
o aplicación de ultrasonido: Permeabiliza temporalmente la membrana
celular y facilita la penetración de carga genética en las células, a través de
frecuencias de ultrasonidos bajas y medias (20kHz a 16MHz), desencadenando la
formación de burbujas llenas de vapor, que finalmente colapsan y forman poros
en la membrana celular, con la limitante de que la transferencia en comparación
con la electroporación no es uniforme. (3)(19)
Microagujas:
Interrumpen el estrato córneo mediante la formación de poros microscópicos a
través de los cuales las biomacromoléculas pequeñas penetran en la epidermis,
cerrándose en 1 hora y dejando la piel intacta. Permiten el paso desde pequeñas
moléculas hidrófilas hasta macromoléculas de alto peso molecular. Son
indoloras, mínimamente invasivas ya que la longitud es de 500 micras por lo que
no alcanzan los nervios de la dermis. Combina la facilidad del uso de un parche
transdérmico con la eficacia de administrar fármacos con jeringas y agujas
hipodérmicas. Se diseñan matrices para mejorar el contacto con la piel y
facilitar la penetración. Dentro de sus limitantes se encuentra la capacidad de
carga limitada y cuando se trate de administraciones en todo el cuerpo. (3)
Métodos de
entrega de vectores no virales:
Es un campo de investigación emergente.
Permite mediar el transporte de los componentes de CRISPR por las propiedades
fisicoquímicas de los vectores sintéticos o naturales. Actualmente los vectores
no virales reportados en la literatura son las nanopartículas (de lípidos,
polímeros, ADN, inorgánicas). Pueden utilizarse in vitro o in vivo, permitiendo
mejorar la seguridad y reducir la inmunogenicidad. (2)
Las
nanopartículas de lípidos (LNP) son unos de los sistemas más utilizados y
avanzados. Consiste en combinar un ácido nucleico con carga negativa y
liposomas con carga positiva, generando interacción electrostática, formando
nanopartículas lipídicas. Este componente lipídico permite al ácido nucleico
cruzar la capa lipídica externa, evitando la reacción inmunitaria. Permitiendo
la entrega de material genético de cualquier tamaño. (2)(3)
Las nanopartículas de polímeros catiónicos
forman complejos esféricos con carga genética negativa por interacciones
electrostáticas. Transportan componentes CRISPR a través de las membranas
mediante endocitosis permitiendo entregar la carga a los objetivos y una
liberación controlada. Los polímeros más utilizados son la polietilenimina
(PEI), poliamidoamina (PAMAM) y quitosano (CS). Sin embargo, dependiendo del
tamaño pueden causar citotoxicidad, por lo que son parámetros que deben
mejorarse para las aplicaciones clínicas. (2)(3)
Los exosomas son nanovesículas liberadas de
forma natural por las células con un tamaño que oscila entre 40 y 160 nm. Su
biocompatibilidad, capacidad de transporte, estabilidad en el torrente
sanguíneo y su capacidad de ingeniería han hecho considerable su uso como
posible tecnología de entrega para los componentes CRISPR. Varios estudios han
indicado que mediante la electroporación, el ADN plasmídico o los mRNA basados
en Cas9 pueden cargarse en los exosomas purificados. Esta tecnología ha
demostrado muchas ventajas como baja inmunogenicidad, alta biocompatibilidad,
cruce de barreras biológicas, pero existe riesgo de integración de fragmentos
de ADN durante la edición del genoma a gran escala. (2)
Métodos de
entrega de vectores virales:
Los vectores virales son los portadores más
efectivos para la entrega de genes debido a su capacidad innata para infectar
tanto células en división como quiescentes. (3)
Los vectores virales contienen virus
adenoasociados (AAV), adenovirus (AdV) y lentivirus. Los AAV y AdV tienen la
capacidad de infección inherente sin desencadenar problemas por mutagénesis por
inserción. El conjunto de partículas virales se empaqueta con Cas9 y sgARN,
luego infectan la célula objetivo que se transportan al cuerpo o se estudian in
vitro. (2) (3)
Los AAV tienen un buen perfil de seguridad
y potencial terapéutico, por lo que se han aprobado para ensayos clínicos en
terapia génica. Su inmunogenicidad es significativamente menor que otros virus.
( 
AdV son virus de dsDNA, que pueden infectar tanto células en división como no
en división. Ha sido utilizado en el establecimiento de enfermedades (Maddalo y
colaboradores en el 2014), descubrimiento de fármacos (Voets en el 2017) y
tratamiento de enfermedades existentes. (2)
El lentivirus es un virus ARN
monocatenario. Está desprovisto de múltiples propiedades virales y no activan
al sistema inmunitario. Como retrovirus se integra en el genoma del huésped,
aumentando el riesgo de mutagénesis insercional fuera del objetivo. (2)
El mayor de los desafíos es el tamaño
limitado de la carga que pueden llevar, siendo superado muchas veces por lo que
han diseñado vectores duales, uno para Cas y otro para sgRNA, que debe ser
entregado simultáneamente. Por lo que el diseño de estos vectores virales
requiere procesos de fabricación complejos y costosos. (3)
En general para avanzar en el campo de la
terapia génica cutánea se necesita una mejor comprensión de cómo administrar la
terapia génica de manera segura y eficiente en células diana. Se necesita
incorporar el uso de modelos relevantes para humanos. Esto aumentará las
perspectivas de implementación a gran escala.
|