Reumatología
La señalización post-receptor en el linfocito T. Claves para el entendimiento de la patogenia de las enfermedades autoinmunes
La ruta Ras/Raf7MAPK en la señalización del linfocito T
Activación de Ras | Móléculas adaptadoras que intervienen en la activación de Ras | Shc | Grb2 | LAT | Otros adaptadores | Otras moléculas que participan en la activación a través de la ruta Ras/Raf/MAPK |
Topografía de las moléculas señalizadoras | MAPKs
Activación de Ras
Ras pertenece a una familia de proteínas G pequeñas con propiedad de GTPasas que interviene con un papel muy importante en el proceso de activación del linfocito T (1). Este grupo de enzimas, que comprende además GTPasas de la familia Rho (involucradas en los procesos de señalización a través de receptores de factores de crecimiento), se caracteriza por activar serina/treonina cinasas de la familia MAPK e interaccionar entre ellas en una "conversación" cruzada. Se pueden acoplar a múltiples efectores cuesta abajo en la cascada de señalización y ser responsables de múltiples salidas funcionales en la célula. Las proteínas inactivadoras de GTPasas (GAPs) inducen la hidrólisis de GTP, favoreciendo el acoplamiento de GDP (que determina una enzima inactiva). A su vez los intercambiadores de nucleótidos de guanina (GEFs) favorecen el desplazamiento de GDP por GTP, induciendo la activación de la enzima. Sos y Vav parecen ser los principales GEFs en las células T.
La activación de Ras inducida a través de receptores de reconocimiento inmunitario requiere la participación de proteína tirosina cinasas (PTKs). Los inhibidores de PTKs pueden prevenir la activación de Ras (2,3). La expresión de una forma disregulada de Lck en lineas celulares de timoma conduce a una activación constitutiva de la vía Ras/Raf/MAPK (4). El otro mecanismo fundamental para la activación de Ras es el sistema de las proteínas cinasa C (PKC). Los activadores específicos de la PKC, como los ésteres del forbol, son capaces de activar directamente a Ras, posiblemente mediante la inhibición de Ras-GAP (5), efecto que no es sensible a los inhibidores de PTKs y que por lo tanto representa una vía directa de activación de esta molécula. Sin embargo, mediante experimentos expresando formas sobreactivadas de PKC, se ha podido demostrar que PKC no actúa por debajo de Ras en la inducción de NFAT y AP-1 (5). Además, en ausencia de estimulación del sistema PKC el ligado del complejo TCR es capaz de inducir directamente la activación de Ras, efecto que es suprimido en presencia de Herbimicina A, un inhibidor de PTKs (2). Estos datos sugieren que la activación de Ras vía TCR/CD3 ocurre a través de una ruta independiente de la PKC e involucra la participación de PTKs. Sin embargo, la posible interconexión de rutas PKC-dependientes y PKC-independientes en la activación de Ras, se pone de manifiesto en la observación experimental de una disminución en la activación de Ras inducida a través de la vía TCR/CD3, en experimentos de depleción sostenida de PKC (3).
Moléculas adaptadoras que intervienen en la activación de Ras
Los mecanismos que acoplan el ligado del complejo TCR/CD3 con la activación de Ras han venido siendo delineados en años recientes. Se han hecho grandes avances en el entendimiento de la activación de la célula T, con el descubrimiento de un grupo de moléculas adaptadoras cruciales en el ensamblaje de esta cascada de señalización (Figura 1).
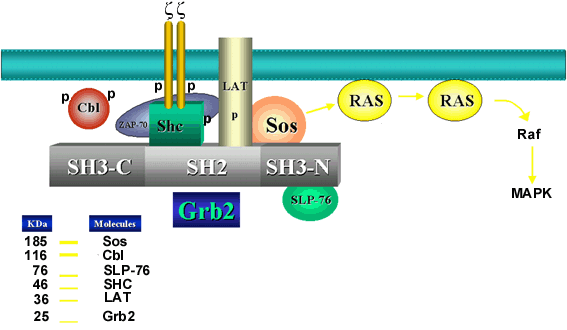
Figura 1. Moléculas que enlazan la señalización del complejo TCR/CD3 (acá sólo representado por el heterodímero zz ) con p21 Ras y el módulo de las MPKs.

Shc
Shc (del inglés SH2-containing domain) es una proteína de 46-52-kDa, compuesta por un dominio fosfotirosina de acoplamiento en su porción aminoterminal, un dominio central de homología con el colágeno que contiene sitios que se fosforilan en tirosina luego del ligado del TCR y un dominio de homología src 2 (SH2) en su porción carboxiterminal, que le permite acoplarse con alta afinidad a proteínas fosforiladas en tirosina, como las cadenas z del complejo TCR. Luego del ligado del complejo TCR/CD3 se produce la fosforilación en tirosina de los dominios ITAM de las cadenas TCR z , lo cual permite el acoplamiento de Shc a través de su dominio SH2. A su vez Shc se acopla a dominios SH2 de Grb2 a través de los sitios fosforilados en tirosina Y239 y Y313 de su dominio central, lo cual permite el acercamiento del TCR z al complejo Shc:Grb2:Sos. Sos es una molécula intercambiadora de GDP por GTP, que interviene en la activación de Ras (7). De esta forma Shc es un eslabón clave en las primeras fases de la señalización via TCR/CD3, al acoplar eventos de fosforilación en tirosina con activación de la ruta Ras/Raf/MAPK en linfocitos T. La ausencia de este acoplamiento en modelos experimentales mutantes de Shc (mutaciones en resíduos de tirosina por fenilalanina) impiden la activación de ERKs, la inducción de apoptosis y la producción de IL-2 en células T activadas a través de la vía TCR/CD3 (8).
Grb2
Grb2 (del inglés Growth factor receptor bound protein 2) es una proteína citosólica de 25-kDa, formada por un dominio SH2 de aproximadamente 100 aminoácidos, y dos dominios SH3 cada uno de 60 aminoácidos que le permite interactuar con secuencias ricas en prolina (9). A través de su dominio SH3 Grb2 liga a Sos (del inglés Son of Sevenless) de manera constitutiva, ligado que aumenta una vez que Sos es fosforilada en serina/treonina. Como se mencionó anteriormente, Sos y Vav son las dos proteínas intercambiadoras de nucleótidos que intervienen en la activación de Ras en linfocitos T. En el momento en que el complejo Shc:Grb2:Sos se acerca a la membrana se activa Ras por intermedio de Sos. No está claro si la activación vía TCR/CD3 induce cambios en Sos que aceleran su actividad GEF (intercambiadora de nucleótidos) o simplemente que el acoplamiento a la membrana acerca a Sos a su blanco natural es decir, la proteína Ras.
LAT
LAT (del inglés Linker for activation of T cells) es una proteína transmembrana de 36-38-kDa, sustrato de varias PTKs y que permite el acoplamiento de eslabones claves en la cadena de señalización tales como Grb2, Sos, PLCg 1 y fosfoinositol 3 cinasa (PI3-K). La asociación de LAT con Grb2 ocurre a través del dominio SH2 de Grb2 (10). Esta asociación es más estable que la de Shc con Grb2, por lo cual ambas moléculas adaptadoras podrían competir por el acoplamiento del complejo Grb2:Sos. Luego de la activación a través del complejo TCR/CD3, LAT es fosforilada por ZAP-70. La mutación de dos resíduos en tirosina de LAT conduce a una disminución en la asociación con Grb2 y PI3-K, así como en el acoplamiento y activación de PLCg 1 (11). LAT también acopla a c-Cbl, el producto de un proto-oncogen que tiene funciones regulatorias negativas en la señalización vía TCR/CD3 (12). Deficiencias en la expresión de LAT determinan una hiperfosforilación de Cbl por Fyn, lo cual induce un acoplamiento más fuerte a una proteína adaptadora (Crkl) y a un factor intercambiador de nucleótidos, C3G, llevando a la activación de Rap-1. Esta proteína G secuestra Raf-1 e impide su participación cuesta abajo en la señalización a través de Ras (13). Por lo tanto, es posible que LAT cumpla una función clave en acoplar ZAP-70 activada con la estimulación de Ras, PLCg 1 y PI3-K en células T (1).
Otros adaptadores
TRIM (del inglés T cell receptor-interacting molecule) es un homodímero transmembrana que se acopla a Grb2, la subunidad p85 de PI3-K y otras src cinasas. Al acoplarse a p85 posiblemente cumpla una función anti-apoptótica. SIT (del inglés SHP2-interacting transmembrane protein) es una proteína de 196-kDa que se acopla a Grb2 y a otras src cinasas (revisado en 13).
Otras moléculas que participan en la activación a través de la ruta Ras/Raf/MAPK
SLP-76
SLP-76 (del inglés SH2-domain-containing leukocyte protein of 76-kDa) es una proteína de 76-kDa que se expresa sólo en células de orígen hemopoyético, y que se acopla a dominios SH3 de Grb2 a través de su región central rica en prolina (14). SLP-76 juega un papel muy importante en el desarrollo ontogénico del linfocito T (15), en la activación de PLCg 1 y la movilización de calcio intracelular (16) y en la inducción de la actividad de transcripción de NFAT y AP-1 (17,18). Estos últimos efectos sugieren que SLP-76 es necesaria para acoplar señales a través de la ruta Ras/Raf-1/MAPK. Más recientemente se ha demostrado también un papel para SLP-76 en la reorganización del citoesqueleto interactuando con Vav y la proteína adaptadora Nck (13).
Cbl
Cbl es una proteína de 120-kDa que se asocia al dominio SH3 de Grb2 y de las PTKs Fyn y Lck en células T (12). En las células T en reposo Cbl se asocia a Grb2, compitiendo potencialmente con Sos por el ligado a esa proteína. Luego de la activación por la vía TCR/CD3 se produce la fosforilación en tirosina de Cbl que conduce a un desacoplamiento de ambas moléculas, facilitando la transmisión de señales hacia la ruta Ras/Raf/MAPK (revisado en 19). Lupher et al demostraron que el dominio PTB (un dominio análogo al SH2) de Cbl reconocía una secuencia de ZAP-70 activada (20). Como se mencionó anteriormente esta molécula cumple un papel regulatorio negativo de la señalización a través de la vía TCR/CD3. La sobreexpresión de Cbl trae como consecuencia una inhibición de la actividad transcripcional de AP-1 en células activadas por la vía TCR/CD3 (17). Timocitos deficientes en su expresión de Cbl afectan la contraregulación negativa de ZAP-70, debido a una fosforilación mantenida de LAT y SLP-76 (21). Datos recientes sugieren que adicionalmente Cbl puede cumplir un papel regulatorio negativo en la señalización vía TCR/CD3 por inducir fenómenos de ubicuitinación de src cinasas (12).
Topografía de las moléculas señalizadoras
En años recientes se ha podido demostrar que las moléculas antes señaladas asumen distribuciones compartamentales en regiones de la membrana y del citoesqueleto, y que este posicionamiento es fundamental para la transmisión de señales. Se ha demostrado la presencia de dominios enriquecidos en glicolípidos de membrana (GEMs, del inglés Glycolipid-enriched membrane domains) mediante técnicas de microscopía electrónica, microscopía confocal y manipulaciones con detergentes. Su estudio añade una nueva dimensión al entendimiento de los procesos de señalización postreceptor en el linfocito T. Diversas moléculas señalizadoras como las src cinasas Fyn y Lck, proteínas de la familia Ras y moléculas que participan en la movilización de calcio, se agrupan en estas "balsas" ricas en esfingolípidos y colesterol en la membrana del linfocito T. Por su parte, la molécula CD45, una tirosina fosfatasa de amplia distribución en la membrana del linfocito T queda excluída de las "balsas" luego del ligado del TCR/CD3, mientras que las cadenas TCR z fosforiladas en tirosina se acumulan en ellas (22). La estimulación vía TCR/CD3 permite la migración de esfingomielina y glicolípidos al sitio de acoplamiento del TCR/CD3 con las moléculas coestimuladoras, creando un plano membranal más rígido, con una mayor capacidad de asociación lateral y en general permitiendo la concentración de las moléculas de señalización en un área más restringida. Una consecuencia del establecimiento de estas balsas es el entrecruzamiento de filamentos de G y F actina en el citoesqueleto, lo cual contribuye a su vez al afianzamiento de esta zona de comunicación intermolecular (Figura 2). Además, luego del ligado del TCR/CD3, la molécula CD48 (una glicosilfosfatidilinositol proteína) se asocia a Fyn y Lck en las "balsas" y potencia la activación de ERK-2 (23). Por el contrario, las moléculas CD45 (con capacidad regulatoria dual de las src cinasas) quedan excluidas para permitir una señalización ininterrumpida (Figura 2).


Figura 2. Se muestra la membrana de un linfocito T en reposo (a) y luego del ligado del antígeno (b). La activación del linfocito T, luego del ligado del antígeno, induce una reorganización a nivel de la membrana mediante la conformación de una zona físicamente más estable, rica en glicolípidos, donde las moléculas que se agrupan interaccionan de manera más directa. A su vez, estas "balsas" excluyen proteínas con capacidad inhibitoria de la respuesta, como la tirosina fosfatasa CD45 (b).

MAPKs
Estudios recientes han aportado una información muy valiosa de cómo se enlaza la señalización desde el complejo TCR/CD3 hasta el sistema de las MAPK (del inglés Mitogen Activated Protein Kinases (revisado en 24). Estas enzimas representan un sistema de serina-treonina proteina cinasas muy conservado filogenéticamente y de amplia expresión en distintos tipos celulares. Las señales transmitidas a través de esta ruta son indispensables para respuestas distales críticas en la biología de cualquier célula. Esta familia de cinasas comprende por lo menos tres grandes grupos, las cinasas reguladas por señales extracelulares (ERKs, de Extracellular signal-regulated kinases), las relacionadas con el proto-oncogen c-Jun (JNK, de c-Jun-related kinases), y las p38 cinasas. La estimulación a través de la vía TCR/CD3 induce activación de las ERKs, por una ruta que involucra Ras/Raf, mientras que la activación de JNKs requiere la participación de la molécula coestimulatoria CD28. La activación de las ERKs requiere la participación de la PKC, posiblemente por el potencial que tiene esta última de activar Raf directamente. Sin embargo, como se señaló anteriormente, una activación completa de Ras/Raf/MAPK solo es posible mediante la participación conjunta y coordinada de señales provenientes del complejo TCR/CD3 y de la activación de PKC. Aproximadamente a los 2-3 minutos de estimulación, Raf-1 se fosforila intensamente y luego se activa, siendo primero reclutada a la membrana mediante la unión a través de su porción amino-terminal a Ras (24). Es posible que PKC sea el principal sistema enzimático encargado de fosforilar a Raf-1, aunque tambien se ha demostrado que Lck induce la fosforilación en tirosina de esa molécula (25).
Luego de activadas Ras y Raf en forma secuencial, se activan MEK1 y MEK2, dos cinasas responsables de la doble fosforilación en treonina-tirosina de ERK-1 y ERK-2 y que conduce a su subsecuente activación. Raf-1 induce fosforilación en los residuos de serina 218 y 222 de MEK-1 (26). MEK-1 y MEK-2 son altamente específicas para la activación cuesta abajo de ERK-1 y ERK-2. Las cinasas MEK fosforilan en forma secuencial la tirosina 185 y la treonina 183 en ERK-2 (27). Las ERKs son serina-treonina cinasas con propensión a fosforilar estos residuos cuando están vecinos a prolina. Dentro de los sustratos que son activados por ERKs estan c-Jun, c-Fos (ambos constituyentes del heterodímero AP-1), c-Myc, c-Myb y Elk-1. En la Figura 3 se muestra un experimento representativo de la doble fosforilación de ERK-1 y ERK-2 en linfocitos T activados in vitro PMA.

Figura 3. Fosforilación de MAPK ERK-1 y ERK-2 inducida por la estimulación con PMA. El panel A muestra las moléculas ERK-1 y ERK-2 doble fosforiladas en residuos de tirosina y treonina en el lisado de 2.5 x 106 linfocitos T de un control sano y un paciente con LES estimulados con 10 ng/ml de PMA. El panel B muestra la cantidad total de proteína ERK-1 y ERK-2 en los mismos lisados.
El sistema MEK/ERK parece ser crítico para la selección positiva intratímica, como se ha podido demostrar en modelos transgénicos que sobreexpresan una forma catalíticamente inactiva de estas enzimas (28). La activación del módulo que comprende Ras/Raf/ERKs es necesaria para la translocación y activación de AP-1 (1), un factor trans-activador que interviene en la regulación de la expresión del gen para IL-2 y de otras citocinas. Igualmente esta vía interviene en la activación de los factores trans-activadores NFAT, AP-3 y NFkB. La activación de AP-1 a través de Ras/Raf es necesaria para la expresión del gen de la molécula CD69 (29), la cadena a del receptor para IL-2 (IL-2R) (30) y para la transcripción del gen de la cadena b del heterodímero TCR (31). |