Dermatología
Estado actual de terapias CRISPR: nueva esperanza en elarmamento dermatológico
Introducción
El manejo de las enfermedades cutáneas
incluye el manejo de los síntomas más que de la causa, siendo estas soluciones
a corto plazo para enfermedades crónicas, con riesgo de desarrollo de efectos
adversos, como infecciones y disrupción de barrera cutánea por lo que surge la
necesidad de desarrollar y aplicar terapias dirigidas a la causa subyacente. Considerando
que la mayoría de las enfermedades cutáneas surgen de mutaciones en el ADN se
plantea la incorporación de terapias CRISPR como una nueva esperanza en el
armamento dermatológico.
El sistema CRISPR, cuyas siglas en inglés
se traducen en “Repeticiones palindrómicas cortas agrupadas y regularmente
interespaciadas”, se observó por primera vez en genomas de arqueas a finales de
1980. Sin embargo, posteriormente fue detectado en una amplia gama de microorganismos
bacterianos, por lo que son comunes en procariotas. (1)
Característicamente este sistema son
secuencias de ADN cortas (23-45bp de largo); palindrómicas porque los
nucleótidos que la conforman se leen igual del extremo 5’ a 3’ y del 3’ al 5’;
repetidas en una región genómica, agrupadas ordenadamente e interespaciadas regularmente
por secuencias que no son iguales entre ellas mismas. (1)
Estas secuencias interespaciadoras son iguales
a regiones o secuencias de ADN pertenecientes a bacteriófagos, las cuales
fueron adquiridas durante una infección primaria, e incorporadas al genoma
bacteriano por el complejo Cas1-Cas2. Conociendo este proceso como adaptación o
adquisición. (1)
Las secuencias CRISPR y las secuencias
espaciadoras se transcribirán como un solo ARN, llamado pre-crARN.
Posteriormente, se transcribirán los ARN transactivadores (tracrARN) los cuales
acudirán al pre-crARN participando en su maduración. (1)
Seguidamente
una ribonucleasa III separa las secuencias de este crARN, en secuencias crARN
más pequeñas, con secuencias espaciadoras individuales. Siendo este el proceso
de expresión.(1)
 
Finalmente, una proteína o enzima Cas se transcribe y forma un complejo con la
secuencia crARN, formando el complejo de interferencia CRISPR/Cas. (1)
Durante una próxima infección por el mismo
fago o plásmido, el material viral interactuará con el complejo CRISPR/Cas que
posee la secuencia espaciadora de este bacteriófago. La secuencia viral
bicatenaria posee una secuencia PAM (Motivo adyacente de protoespaciador) en el
extremo 3’. Estos PAM solo se encuentran en el material genético viral y el
sistema CRISPR/Cas debe reconocerlo para activarse. (1)
Al reconocer estos PAM el complejo comienza
a separar la hebra bicatenaria del material viral y las enzimas Cas utilizan su
actividad de endonucleasa, cortando o degradando el material viral e
inactivándolo. (1) (Figura 1)  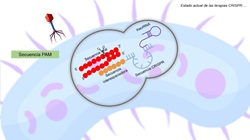
Figura 1. Mecanismo de acción del sistema CRISPR/Cas De esta manera, se observa que el sistema
CRISPR/Cas le confiere a la célula una forma única y hereditaria de inmunidad
adaptativa. (1)
Durante los
últimos 15 años se ha avanzado en la comprensión de las funciones alternativas
del sistema CRISPR/Cas. (1)
Dentro de sus funciones, además de la
inmunidad adaptativa, se encuentran la modulación de la fisiología celular,
virulencia y comportamiento bacteriano, incluyendo la formación del biofilm, regulación de genes y
remodelación del genoma. (1)
Dado el creciente potencial del sistema
CRISPR/Cas el campo de aplicación es amplio e incluye inhibición de
transferencia horizontal de genes, tipificación de especies bacterianas, y
edición genética. (1)
A través de sistema CRISPR mediado por Cas9
se logran introducir roturas en el dsDNA de células de mamíferos, utilizando
RNA de guía única (sgRNA), portador de una secuencia complementaria a la
secuencia objetivo, logrando modificar esta secuencia. Esto ha permitido
plantear el uso del sistema CRISPR/Cas para el tratamiento de enfermedades
cardiovasculares, trastornos genéticos, autoinmunes, oncológicos,
inflamatorios, bacterianos, incluso para desarrollar vacunas contra SARS-CoV-2.
(1)
Debido a los avances en estudios genéticos
y biología molecular se sabe que las enfermedades cutáneas derivan de cambios
en el ADN. Tal es el caso de las genodermatosis como epidermólisis bullosa e
ictiosis congénita, en donde ocurren mutaciones genéticas monogénicas, por lo
que han sido modelos para la aplicación de terapias de edición génica en
modelos murinos y celulares. (5)
CRISPR y las nucleasas asociadas a CRISPR
(Cas) permiten la edición de objetivos moleculares precisos, secuencias de ARN
o ADN, por lo que este grupo de enfermedades han sido modelo para la aplicación
de por CRISPR/Cas9.(4) (5)
Hasta la fecha los ensayos clínicos de
terapia génica en las genodermatosis se centran en epidermólisis bullosa
(epidermólisis ampollosa de la unión y epidermólisis ampollosa distrófica
recesiva o RDEB) y síndrome de Netherton. (4)
Dada todas las consecuencias derivadas de
la edición génica como mutagénesis insercional, las terapias de edición génica
en RDEB deben ser de alta precisión mediante el empleo de nucleasas como
nucleasas efectoras similares a activadores de transcripción (TALEN) y por
supuesto, CRISPR/Cas. (6) En un estudio
realizado por Bonafont y colaboradores en el año 2019 se demuestra la eficacia
y seguridad de una terapia que emplea Cas9 guíado por sgARN administrado en
forma de ribonucleoproteína por electroporación para extirpar con precisión el
exón 80 del gen COL7A1 que porta la mutación en la RDEB, incorporando intrones
funcionales de donantes. Se confirmó la restauración adecuada estudiando la
transcripción de COL7A1 mediante RT-PCR, demostrando la prevalencia de
transcritos que carecen de E80 en células editadas. (6)
Las limitaciones del sistema CRISPR/Cas9
incluyen la división inespecífica en sitios no deseados (actividad fuera del
objetivo) que sean similares a la secuencia objetivo. Sin embargo, no existen
herramientas para predecir si esto ocurrirá, pudiendo conducir este error a
mutaciones o reordenamientos inesperados que pueden culminar en oncogénesis.
(4)
CRISPR/Cas tiene el potencial de
revolucionar la terapia celular y génica para la genodermatosis, siempre que
las limitaciones actuales sean superadas. (4)
Al conocer que las genodermatosis presentan
mutaciones genéticas monogénicas, que son blanco terapéutico en dichas terapias
de edición génica por CRISPR/Cas, surge el interés por conocer en cuáles otras
enfermedades dermatológicas pudieran ser manejadas con edición génica.
|