En
los sujetos sanos la liberación de la insulina está exactamente controlada para
alcanzar las demandas metabólicas, las células β detectan los cambios en la
glicemia y liberan la cantidad exacta de insulina (33). Para
detectar el estado nutricional las células β están agrupadas en islotes los cuales
están conectados estratégicamente con los vasos sanguíneos. Los islotes forman
una densa red con los vasos sanguíneos pequeños y reciben 10 veces más sangre
que el tejido exocrino circundante. Los capilares que irrigan los islotes están
fenestrados, estructura que incrementa la permeabilidad capilar, lo cual
permite un íntimo contacto de las células β con los nutrientes presentes en la
sangre, así mismo facilita que la insulina secretada alcance la circulación (34).
Además de la glucosa, algunos aminoácidos y ácidos grasos pueden regular la
secreción de insulina.
La secreción de insulina se
realiza mediantes dos mecanismos: uno relacionado con los canales de K+
dependientes de ATP y otro que es independiente de dichos canales. A
continuación discutiremos ambos mecanismos.
Secreción de insulina dependiente de canales de K+ATP.
Los
islotes de Langerhans son pequeños órganos encargados de detectar los cambios
en las cantidades de los nutrientes y hormonas presentes en el medio ambiente
que los rodea, además de responder a estímulos nerviosos. El aparato secretor
de insulina de las células β está equipado con controles metabólicos en
diferentes etapas de señalización que están bajo riguroso control. La
maquinaria metabólica de las células β está diseñada para detectar las
variaciones de la glicemia y liberar insulina de acuerdo a los requerimientos
el organismo(35). Además de la glucosa, algunos aminoácidos
incluyendo glutamina y leucina, así como los ácidos grasos son capaces de
estimular la secreción de insulina en respuesta a la glucosa (35,36).
La estimulación de la secreción de insulina en la fase temprana pre-absortiva
es mediada por la inervación parasimpática de los islotes (37.
El
metabolismo de la glucosa en las células β, corre paralelo con el incremento en
la producción de ATP y el consecuente aumento de la relación ATP/ADP lo cual
condiciona el cierre y la inhibición de los canales de potasio dependientes de
ATP (K+ ATP) despolarizándose la membrana plasmática. Los canales de K+ATP
son un complejo constituido por 4 subunidades del receptor sensibles a las
sulfonilureas 1 (SUR 1, por sus siglas en
inglés), las cuales son las subunidades regulatorias sensibles a ATP y que se
encuentran rodeando a 4 subunidades del canal iónico de potasio (Kir6.2)
propiamente dicho. Cuando la relación ATP/ADP se incremente la subunidad SUR1
une ATP cerrando el canal iónico de K+ con lo cual se incrementa la
concentración intracelular del catión, despolarizándose la membrana plasmática.
En respuesta a la despolarización de la membrana plasmática por el cierre de
los canales de K+ATP se
abren los canales de Ca++ tipo L dependientes de voltaje y se
produce un influjo de Ca++ lo
cual es conocido como uno de los eventos primarios en la exocitosis de la
insulina (Ver Figura 6) (38).
La
habilidad de las células β de responder a las fluctuaciones de la glicemia en
un rango comprendido ente 3 y 16 mM se puede realizar gracias al concurso
de dos proteínas; la primera de ellas es el transportador de glucosa
independiente de Na+ (GLUT 1 en el hombre y GLUT 2 en roedores) que
presenta un alto KM para la glucosa (≈ 17 mM) lo cual permite un
rápido equilibrio de la concentración de glucosa intra y extra celular; la otra
es la hexoquinasa IV o glucoquinasa, la cual cataliza la primera reacción de la
utilización de la glucosa y en particular de la glicólisis con un KM para
la glucosa de ≈ 10 mM(39). La combinación de la participación del
GLUT 1 y de la glucoquinasa condicionan un incremento de la glicólisis y del ATP, casi paralelamente con
el incremento de la glicemia y en consecuencia una liberación de insulina
proporcional al cambio en la concentración de glucosa en sangre (35).
En las células β la glicolisis y el ciclo de Krebs están estrechamente
relacionados por la baja expresión genética de la lactato deshidrogenasa lo
cual permite aún más un paralelismo entre la glicemia, la producción de ATP y
la secreción de insulina (40).
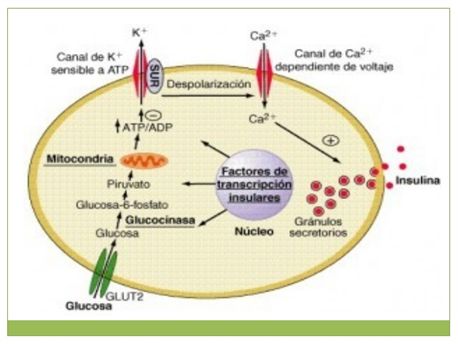
Figura 6. Mecanismo
de la secreción de insulina por las células β pancreáticas dependiente de los
canales K+ATP. La utilización de la glucosa, por las
células β corre paralela con la glicemia gracias a la participación del GLUT 2
(en roedores) y de la glucoquinasa, con lo cual la síntesis de ATP está
relacionada con la glicemia. El incremento de la relación ATP/ADP cierra los
canales de K+ATP despolarizándose la membrana plasmática lo
cual condiciona la apertura de los canales de Ca++ produciéndose la
liberación de insulina. Para detalles ver el texto.
La
secreción de insulina está orquestada por varios factores, evidentemente el Ca++
es uno de ellos, además existen efectores proteicos de la exocitosis
asociados a las vesículas (un factor soluble sensible a
N-etilmaleimida que se une a un receptor proteico, SNARE por sus siglas en
inglés), que contienen insulina, y a
la membrana plasmática lo cual facilita la fusión entre ambas (41).
La secreción de insulina transcurre en dos fases,
la primera consiste de un pico inicial que ocurre entre 3 y 10 minutos de la
ingesta de alimentos y una segunda fase de desarrollo más lento; la primera
fase está disminuida en los pre-diabéticos y está casi totalmente ausente en los
diabéticos tipo 2 con una disminución
variable de la segunda fase (42). De los aproximadamente 13.000
gránulos de insulina que existen en la
célula β unos 500 están adosados a la membrana plasmática y
de estos unos 100 muy próximos a los canales de Ca++ y que son los
que contribuyen a la primera fase de secreción; una vez que estos han liberado
la insulina, son reemplazados por el reclutamiento de otros gránulos
produciéndose la segunda fase más sostenida (43).
Secreción
de insulina independiente de los canales de K+ATP
Las
incretinas son hormonas producidas en el intestino en respuesta a la ingesta de
alimentos, y que han sido reconocidas como estimuladoras fisiológicas de la
secreción de insulina(44). El polipéptido insulinotrópico dependiente de glucosa (GIP por sus siglas en
inglés) es secretado por las células K, ubicadas en la parte proximal del
intestino delgado y el péptido 1 similar al glucagón (GLP 1 por sus siglas en
inglés) es producido por las células L ubicadas en la porción distal del
intestino delgado y el colon (45).
Tanto
GIP como GLP 1 se unen, en las células β pancreáticas, a un receptor de
membrana constituido por 3 subunidades, el cual por medio de una proteína G
estimula la adenilato ciclasa, ésta enzima a su vez incrementa la concentración
intracelular de AMPc y éste estimula la secreción de insulina por un mecanismo dependiente de la vía de la proteinquinasa A (PKA por sus
siglas en inglés) y otro dependiente de una proteína intercambiadora estimulada
directamente por AMPc 2 (Epac 2 por sus siglas en inglés). El mecanismo por el cual la vía de PKA estimula la secreción de
insulina no está claro pero es independiente del cierre de los canales de K+ATP
y la subsecuente despolarización de las células β y el incremento de Ca++
intracelular, pero si está estrechamente relacionado con la concentración
sanguínea de glucosa (Ver Figura 7) (46).
Por otro lado, Epac 2 se une a AMPc y funciona como un factor intercambiador de
nucleótidos de guanina para las proteínas de bajo peso molecular similar a Ras,
denominada Rap 1. La interacción de Epac 2 con Rap 1 es un evento crítico para
promover la exocitosis de las vesículas que contienen insulina; además Epac 2
interactúa con una proteína de andamiaje denominada Rim 2 la cual está
localizada tanto en la membrana de las vesículas secretoras como en la membrana
plasmática, lo cual permite las etapas de acoplamiento e iniciación de la
exocitosis (47).
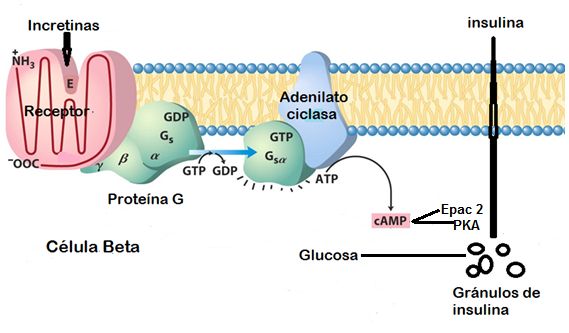
Figura 7. Secreción
de insulina por las células β mediada por incretinas e independiente de los
canales K+ATP. Las
incretinas se unen a receptores de membrana en las células β los cuales por
modulación de proteínas G condicionan el incremento en AMPc y éste estimula la
proteína quinasa A y a Epac 2, aumentándose la liberación de insulina por un
mecanismo desconocido pero dependiente de glucosa.
Regulación de la secreción de insulina
a.-
Glucosa. Éste carbohidrato es el estímulo primario para la liberación de
insulina en muchos animales incluyendo el hombre; en humanos, la ingesta de 75
g de glucosa incrementa los niveles de insulina desde el basal, de 20-30
pmol/L, hasta 250-300 pmol/L en 30 minutos, mientras que una ingesta similar de
lípidos o de lípidos más proteínas solo incrementa los valores de insulina hasta
50-60 pmol/L (48).
Las células β no cuentan con
un receptor de membrana para la glucosa que les permita detectar los cambios de
concentración; sin embargo el mecanismo antes descrito (Secreción de insulina
dependiente de los canales de K+ATP) les permite a las
células β adecuar finamente la secreción de insulina a la glicemia.
La ingesta de una cantidad
de glucosa incrementa más la secreción de insulina que la administración
intravenosa de una cantidad similar de glucosa (49) debido a la
liberación de las incretinas por las células del intestino que incrementa la
secreción de insulina (Secreción de insulina independiente de los canales de K+ATP).
b.- Aminoácidos. En general
los aminoácidos individuales son pobres secretagogos de insulina, sin embargo
algunas combinaciones de aminoácidos, a concentraciones fisiológicas o
superiores pueden estimular la secreción de insulina tal es el caso de la combinación
de glutamina y leucina (50).
c.- Ácidos grasos.
Recientemente se ha demostrado que las células β tienen receptores para los
ácidos grasos y que por medio de los mismos dichas moléculas influencian la
liberación de insulina (51).
d.- Estrógenos. Las células
β no son blancos clásicos de los estrógenos, sin embargo en dichas células se
encuentran receptores estrogénicos. La principal consecuencia fisiológica de la
acción del 17 β estradiol es el incremento de la secreción de insulina (52).
e.- Melanotonina. Es la
hormona producida por la glándula pineal, la misma atenúa la liberación de
insulina por las células β probablemente por disminución de la producción de
AMPc (53).
f.- La leptina es secretada por el tejido adiposo
y es conocida la influencia que tiene sobre el efecto de la insulina en los
tejidos adiposo y hepático. Generalmente se acepta que tiene un efecto
inhibitorio sobre la liberación de insulina (54).
g.- Hormona de crecimiento.
Una de las acciones mejor conocidas de la hormona de crecimiento es la
estimulación de la síntesis del factor I de crecimiento similar a la insulina,
el cual disminuye los niveles séricos de insulina y péptido C en humanos (55).
H.- Acetilcolina y
colecistoquinina. Este neurotransmisor y la hormona producida por el duodeno
potencian la secreción de insulina mediante el catabolismo del fosfoinositol (9).
Ambas moléculas se unen a sus respectivos receptores en la membrana plasmática
de las células β y mediante proteínas G activan la fosfolipasa C, la cual hidroliza
al fosfatidilinositol 4,5-bisfosfato (PPI2 por sus siglas en inglés)
produciendo inositol 1,4,5-trifosfatto (IP3 por sus siglas en inglés) y
diacilglicero, los cuales actúan como segundos mensajeros liberando calcio del
retículo endoplasmático(9). El incremento del calcio citosólico incrementa la liberación de insulina como se
describió antes (Secreción de insulina dependiente de los canales de K+ATP).
Depuración
y degradación de insulina
La captura y degradación de
la insulina es una característica de todos los tejidos sensibles a la hormona
(56). A concentraciones fisiológicas, la captura de insulina está mediada
por el receptor con una mínima participación de procesos no específicos. La
vida media de la insulina es de 4 a 6 minutos, como se pudiera esperar de una
rápida respuesta a los cambios de la
glicemia (56).
El hígado es el principal
órgano depurador de insulina, es capaz de captar el 50% de la hormona presente
en la circulación portal (57). La depuración hepática de la insulina
está disminuida en la diabetes y la obesidad (58). El riñón depura
el 50% de la insulina de la circulación general y el 70% del péptido C
circulante por filtración glomerular, reabsorción y degradación (59).
Además de hígado y riñón el tejido muscular juega un papel importante en la
depuración de insulina (58).
En condiciones normales la
casi totalidad de la insulina es degradada intracelularmente o por lo menos en
procesos que ocurren a nivel de la membrana plasmática (58). La
etapa inicial, en la toma de la insulina por las células, es la unión de la
hormona a su receptor, constituyendo un reservorio de insulina la cual puede
regresar a la circulación o ser internalizada (60). La insulina
unida al receptor es internalizada en vesículas endocíticas, donde puede
ocurrir el inicio de la degradación de la hormona gracias a la participación de
una enzima específica que degrada insulina (IDE por sus siglas en inglés) o ser
transferida intacta a otros organelos intracelulares como el núcleo, el aparato
de Golgi, el citosol, entre otros (58) o su liberación de la célula
intacta por diacitosis o retroendocitosis 58). La degradación de la
insulina se puede considerar como un mecanismo de terminar su acción.