Microbiología
Factores asociados con la respuesta inmunológica en el Lupus cutáneo
Respueta inmunológica en el lupus cutáneo
Diversos
factores influencian la evolución de las manifestaciones clínicas
del lupus y el curso o espectro que toma la enfermedad. Mencionaremos brevemente
los aspectos más relevantes de los factores que con mayor frecuencia
se relacionan con el desarrollo de la patología a nivel inmunológico,
enfatizando en su mecanismo de acción.
Radiaciones
ultravioleta
Las radiaciones
ultravioleta (UV) se relacionan estrechamente con la presentación de
las manifestaciones clínicas a nivel cutáneo, en la piel esto
se evidencia con lesiones de fotosensibilidad en más del 75% de los pacientes
con LES y en la casi totalidad de los pacientes con lupus confinado a la piel.
Las características y efectos biológicos de las radiaciones ultravioleta
a nivel cutáneo son bien conocidos y se relacionan directamente con su
longitud de onda. Presentamos los más resaltantes en el cuadro resumen
número 2:
Características |
UVB |
UVA |
Penetración |
Epidermis
|
Dermis |
Absorción
por moléculas
|
DNA,
melanina, aminoácidos |
Melanina |
Daño
directo DNA |
Aumentado |
Menor |
Producción
radicales libres |
Menor
|
Aumentada |
Efecto
epidérmico |
Adelgaza
estrato córneo, apoptosis intermedia, liberación citocinas
queratinocitos |
Apoptosis
intermedia |
Células
Langerhans |
Inactivación,
migración |
Menor |
Endotelio |
Daño
vasos dermis papilar |
Daño
vasos dérmicos |
Cuadro
2. Características y
efectos biológicos de las radiaciones UV a nivel cutáneo.
Modificado
de: Wallace D, Dubois EL. Lupus Erythematosus. Sixth Edition. Lippincott
Williams and Wilkins Publisher. 2002:551-71. (12)
|
La formación
de dímeros de timidina y la liberación de autoantígenos,
se relacionan con la iniciación de fenómenos de apoptosis. Las
radiaciones ultravioletas tipo B (UVB) inducen la producción de anticuerpos
contra los componentes nucleares, dando un patrón de respuesta Th2, donde
la activación de receptores de membrana (Fas y Fas ligando), la liberación
de TNF-α,
y su unión con el receptor p53, además de la activación
de la vía de las caspasas ante el daño al DNA, generan una respuesta
de autoinmunidad que tiende a permanecer en el tiempo (cronicidad), más
aún si persiste el fotodaño por una continua exposición
a las radiaciones solares sin protección adecuada. Las radiaciones ultravioleta
tipo A (UVA) se relacionan con una respuesta tipo Th1; donde los fenómenos
de apoptosis cobran especial importancia, en la presentación más
favorable que se observa en ciertos tipos de lupus cutáneo. La acción
de las radiaciones ultravioleta sobre las células cutáneas se
presenta en el cuadro siguiente:
Células |
UVB |
UVA |
Queratinocito |
IL-1,
TNF α,
GM-CSF, IL-6, IL-8, IL-10, TGF-α
PGE2, PGF2α
|
IL-8,
IL-10, IL-12, PGE2, PGF2α |
Mastocito
|
TNF
α,
LTC4, LTD4, PGD, Histamina |
|
Célula
endotelial |
TNF
a, PCI2 |
PCI2 |
Célula
Langerhans |
|
IL-12 |
Cuadro
3. Efecto
estimulador inmunológico de radiaciones UV en células
cutáneas.
Modificado
de: Wallace D, Dubois EL. Lupus Erythematosus. Sixth Edition. Lippincott
Williams and Wilkins Publisher. 2002:551-71. (12)
|
Estas respuestas
son influenciadas por la diferente longitud de onda y la penetración
que tienen estas radiaciones a nivel de las diferentes capas de la piel (UVB
penetran hasta epidermis y UVA hasta dermis) (12). El mecanismo de expresión
de antígenos nucleares y traslocación de los antígenos
citoplasmáticos (Ro por ejemplo), en los queratinocitos, genera la respuesta
de anticuerpos específicos (anticuerpos anti Ro), los cuales se correlacionan
con la actividad de la enfermedad y la presencia de las lesiones cutáneas
(13). A continuación presentamos un diagrama resumen de la acción
de las radiaciones ultravioleta:
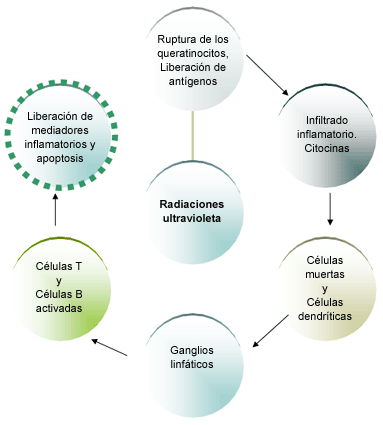
Diagrama
1. Efecto de las radiaciones ultravioleta sobre los queratinocitos
y sus consecuencias. |
Infecciones
Las infecciones
son factores que modifican el curso de la enfermedad lúpica, siendo las
más estudiadas las causadas por virus, no siendo menospreciables las
debidas a bacterias, ya que en la actualidad ellas son foco de grandes estudios.
Entre los virus que con mayor frecuencia se relacionan con exacerbaciones de
las manifestaciones cutáneas del lupus tenemos los herpes virus (Varicella
zoster, Epstein Barr y Citomegalovirus), virus de la hepatitis
C, parvovirus B19 y virus de la rubéola. El mecanismo propuesto para
la acción inmunológica de los agentes infecciosos como exacerbantes
del lupus, se cree que es debido a una reacción cruzada por la similitud
entre el antígeno Sm (Ag Sm) y la proteína p24 gag de los virus,
y el antígeno Ro (Ag Ro) con proteínas de nucleocápside
viral, y es por ello que los fenómenos de autoinmunidad se manifiestan
en infecciones que tienden a la cronicidad. A continuación presentamos
un diagrama resumen de estos mecanismos:
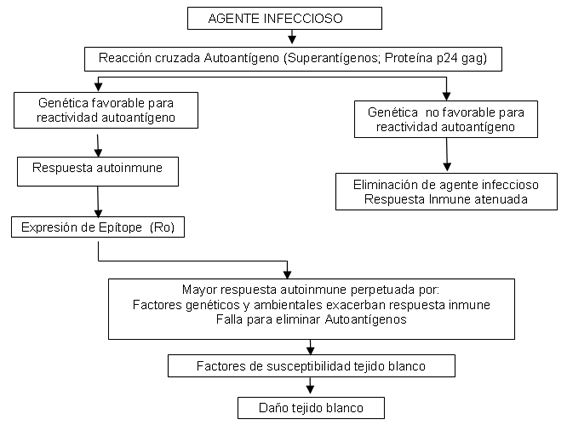
Diagrama
2. Papel de las infecciones en el desarrollo de lupus cutáneo. |
Las infecciones
crónicas tienden a asociarse con una respuesta inmunológica de
tipo Th2, donde la persistencia de los agentes causales se podría relacionar
a un estimulo nocivo permanente a nivel cutáneo, condicionando efectos
más deletéreos de los que se observan en la historia natural de
la patología lúpica. En lo concerniente a las infecciones agudas
virales o bacterianas, estas estimulan fenómenos de actividad de la enfermedad
lúpica subyacente, los cuales revierten en su mayoría al erradicarse
la infección. En las infecciones parasitarias la respuesta inmunológica
ante la cronicidad no afecta mayormente las manifestaciones del lupus cutáneo,
con la excepción de los pacientes que presentan un conocido terreno atópico
y responden exacerbando sus manifestaciones cutáneas en respuesta a eosinofilia
y aumento de inmunoglobulina E (IgE), ameritando control sintomático
y terapéutica patógeno-específica.
En la actualidad
el centro del estudio de los fenómenos de autoinmunidad en el lupus en
relación a las infecciones y su diferente grado de agresividad y exacerbación
de la respuesta inmunológica se centra en el papel de ciertos determinantes
de patogenicidad principalmente a nivel bacteriano, conocidos como superantígenos,
siendo muy bien estudiados y caracterizados en los bacilos entéricos
gramnegativos y especialmente entre los microorganismos grampositivos en uno
de los principales patógenos humanos, Staphylococcus aureus,
cuyo peptidoglicano, toxinas de shock toxico y enterotoxinas tienen la capacidad
de activar a los macrófagos y linfocitos de forma directa (sin requerir
células presentadoras de antígenos, ni moléculas de activación
celular), lo cual genera la producción de citocinas y activación
de las cascadas del complemento y la coagulación con grandes incrementos
de interleucinas (IL) 1,2 y de TNF-α.
Todo lo anterior se expresa como fenómenos pirogénicos, inflamatorios
y caquectizantes que se verifican en los períodos de actividad del lupus,
asociados a infecciones.
Fármacos
Los agentes
terapéuticos de diferentes clases se han asociado como inductores de
respuestas inmunológicas y productores de fenómenos que simulan
autoinmunidad. Diferentes clases de medicamentos (antihipertensivos, antimicóticos,
antimicrobianos, anticonvulsivantes, antineoplásicos) se relacionan con
aparición secundaria de lupus tanto sistémico como cutáneo,
los más frecuentemente implicados se listan a continuación: Hidroclorotiazida,
Griseofulvina, Terbinafina, Minociclina, Inhibidores de la enzima convertidora
de angiotensina (IECA), Bloqueantes de canales de calcio, Atenolol, Fenitoína,
Hidralazina, Procainamida, D-Penicilamina, Isoniacida, Cocaína, Clorpromazina,
Etarnecept, Docetaxel, Interferón. Los primeros casos de lupus like
se reportaron en pacientes hipertensos arteriales en quienes se combinaron los
diuréticos de asa con los inhibidores de la enzima convertidora de angiotensina,
mejorando las manifestaciones cutáneas una vez que era suspendido o cambiado
el tratamiento. Similar situación se ha observado en el tratamiento de
la tuberculosis sintomática, y más evidente ha sido en su profilaxis
con la monoterapia con la hidrazida del ácido nicotínico (isoniacida
-INH-), ameritando su cambio por otros antimicobacterianos, con la subsiguiente
mejoría sin lesiones residuales a nivel cutáneo.
El ejemplo
más estudiado en la actualidad para explicar la inducción de lupus
por ingesta medicamentosa se presenta con un antineoplásico empleado
en el tratamiento del cáncer de mama (Docetaxel), cuyo efecto inductor
de apoptosis se cree que contribuye a la liberación de nucleosomas, los
cuales se constituyen en antígenos (autoantígenos) para desencadenar
autoinmunidad en el lupus eritematoso cutáneo subagudo (14). Similares
efectos se han descrito para otros medicamentos de esta clase, pero la prueba
experimental de ellos no ha sido reproducible ni verificable de manera fidedigna.
Las reacciones
mediadas por inmunoglobulina E y liberación exagerada de histamina se
pueden observar frecuentemente en los pacientes que presentan manifestaciones
de lupus like, y uno de los pilares de la terapéutica es emplear
inhibidores de la liberación de histamina, antagonistas de los receptores
de histamina tipo 1 y 2, además de utilizarse en casos graves los corticoesteroides
como medidas extremas ante la presencia de episodios de angioedema que comprometan
la vida del paciente.
Tabaquismo
La asociación
entre el hábito tabáquico y el desarrollo de lupus se ha estudiado
desde hace muchos años, pero en la década de los años noventa
se presentaron tres estudios importantes, donde uno era contrario a esta asociación
(Reidenberg y colaboradores, 1993) y los otros dos (Nagata y colaboradores,
1995; Hardy y colaboradores, 1998) respaldan dicha relación apoyándose
en el consumo elevado superior a 20 paquetes/año y su asociación
con las manifestaciones clínicas de la enfermedad lúpica; siendo
este consumo tabáquico elevado igualmente factor de riesgo para enfermedad
isquémica cardíaca.
Bien conocidos
son los efectos del tabaco sobre las células de la mucosa respiratoria
a nivel funcional y su elevado potencial oncogénico, su acción
inhibidora sobre la producción de factor de crecimiento epitelial (asociada
a alteraciones gástricas), su efecto nocivo sobre los niveles de inmunoglobulina
A secretoria (IgAs), todos los cuales contribuyen a condicionar infecciones
y cambios dañinos en las mucosas, los cuales se asocian directa e indirectamente
con la presencia de diferentes enfermedades, de las cuales no escapa el lupus.
Los mecanismos
propuestos para la inducción de lupus son basados en la cantidad de compuestos
nocivos que se presentan en el humo (compuestos bencénicos, monóxido
de carbono), los cuales se asocian con mutaciones del DNA, activación
de oncogenes y protooncogenes (unión en calidad de promotores a los sitios
iniciales del oncogén celular), aumento de la mitogénesis en los
linfocitos (T y B), aumento en la expresión factor tisular de monocitos,
producción de diferentes factores inmunomoduladores y alteraciones en
la irrigación sanguínea por la vasoconstricción, asociado
con las manifestaciones vasculíticas y principalmente con fenómeno
de Raynaud (15).
El efecto
del tabaco en la producción del lupus cutáneo parece ser directamente
proporcional a un elevado consumo, ya que cabe destacar que los efectos del
mismo son acumulativos a nivel celular y se requiere un período mayor
a los diez años de suspensión del hábito para lograr una
eliminación de la mayor parte de sus toxinas.
Dieta
Ciertos componentes
de la dieta se han relacionado con una mejoría de las manifestaciones
cutáneas, entre lo que destacan la vitamina C, la cual por su efecto
antioxidante impide la acción nociva de los radicales libres sobre las
membranas celulares. Asimismo, juega un papel importante como inmunomodulador,
actuando sobre los mediadores inflamatorios, inhibiendo su acción y mejorando
los síntomas de la enfermedad. Igualmente la vitamina E es bien conocida
como un potente antioxidante, y en la actualidad se preconiza su consumo junto
a la vitamina C y oligoelementos como el zinc.
La acumulación
persistente del aminoácido homocisteina, lesiona las células endoteliales,
induciendo la formación de ateroesclerosis prematura de la aorta y sus
ramas, las arterias periféricas y las arterias cerebrales (16). Debido
a la predisposición de los pacientes con LE a presentar fenómenos
de vasculitis, no se recomienda que éstos ingieran cantidades elevadas
del mismo, más aún en aquellos pacientes con enfermedad sistémica
y asociación de síndrome antifosfolípido, pues el estado
protrombótico se ve potenciado.
Se ha establecido
una relación no causal entre el consumo de alfalfa con la aparición
de las lesiones cutáneas debido a la presencia del aminoácido
L-canavalina, por lo cual se recomienda omitir su consumo en quienes tienen
un diagnóstico de enfermedad lúpica (17).
El consumo
de ácidos grasos no se ha relacionado de manera directa con la producción
y evolución del lupus cutáneo, sin embargo y en aras de disminuir
los fenómenos de ateroesclerosis asociados a isquemia y daño a
la microcirculación, se recomienda consumir preferiblemente los de tipo
poliinsaturado.
Los alimentos
con abundantes sustancias preservativas (enlatados, embutidos), son considerados
como no deseables en la dieta del paciente lúdico, ya que ellos pueden
exacerbar fenómenos alérgicos y condicionar empeoramiento de la
enfermedad cutánea y sistémica. Lo anterior es valido para el
consumo de refrescos de cola y alimentos ahumados.
Estrés
Uno de los
factores que ha cobrado más importancia en estos tiempos en cuanto a
la etiología de las enfermedades es el estrés. Su efecto
como inmunosupresor ha sido muy discutido y comprobado en el área de
la psiconeuroinmunología, siendo actualmente uno de los blancos de las
psicoterapia para pacientes con enfermedades crónicas como es el caso
del LE. En este sentido se ha comprobado el efecto del estrés como exacerbante
de las manifestaciones cutáneas, principalmente la alopecia y el prurito.
La angustia
persistente aumenta la actividad de la enfermedad lúpica favoreciendo
el daño a órganos blanco. La generación de dolor constante,
entorpece la capacidad para llevar a cabo las actividades cotidianas, aunado
esto al ascenso de la morbilidad por causa de la inmunopatía (18).
La depresión
puede condicionar el aumento de actividad del lupus, aunque los mecanismos por
los cuales se produce este empeoramiento no se conocen en su totalidad, se ha
observado beneficio en aquellos pacientes en quienes se ha instrumentado medicación
antidepresiva o intervención familiar y personal positiva.
Sustancias
químicas
Dentro de
las sustancias químicas más estudiadas se encuentran las empleadas
en estética, como es el caso de los tintes para el cabello. Clásicamente
se han descrito como agentes asociados a la producción de lupus, pero
con la salvedad de que deben ser empleados por largos períodos de tiempo
(mayores a 6 años) y con una composición química especial
que incluya dentro de sus componentes a ciertos agentes implicados en fenómenos
relacionados con respuestas alérgicas (parafenilendiamina).
Es de hacer
mención que la respuesta a estos compuestos depende de la idiosincrasia
del paciente, pues pueden ser promotores de reacciones inmunológicas
como las observadas en alopecia areata. Su efecto en el paciente lúpico
no ha sido bien definido, pero es costumbre entre algunos especialistas la indicación
de abstención del uso de dichos compuestos durante tiempos prolongados
o el consejo de realizar la rotación de los mismos para evitar la sensibilización
a ellos (19).
Las prótesis
mamarias de silicón han sido relacionadas en la década de los
noventa con diferentes enfermedades del tejido conectivo (LES, esclerodermia,
artritis reumatoidea, síndrome de Sjögren, dermatomiositis), pero
los últimos meta análisis han revelado que no existe asociación
estadísticamente significativa entre los implantes mamarios empleados
anteriormente (silicón) y los que se emplean en la actualidad (solución
salina), con el desarrollo de la enfermedad del tejido conectivo (20). Es de
destacar que muchos de estos meta análisis han sido financiados por la
industria farmacéutica y de la estética.
En la consulta
diaria se les aconseja a las pacientes abstenerse de la colocación de
cualquier tipo de dispositivo protésico estético, procedimientos
invasores (lipoescultura) o de otra índole (mesoterapia), no sólo
por los problemas referidos a ellas mismas, sino por las complicaciones que
se presentan durante la cicatrización y el post-operatorio debido a los
condicionantes inherentes a la terapia de la enfermedad lúpica y a los
epifenómenos que la acompañan y aún no han sido bien esclarecidos.
Una de las
complicaciones más temidas en aquellas pacientes que se realizan injertos
autólogos o heterólogos de colágeno o biopolímeros
es la paniculitis lúpica, la cual se produce por una reacción
inflamatoria a nivel del tejido adiposo, aparentemente secundaria a la liberación
de mediadores inflamatorios, secundaria a traumatismos o en respuesta a la presencia
de cuerpos extraños, y que característicamente presenta el ?fenómeno
del reflejo? (fenómeno de Koebner), donde una vez que se establece
la lesión inicial, aparecen lesiones en otros sitios diferentes que sen
víctimas de injurias (traumatismos). No existe nueva generación
de tejido grado en los sitios afectados, por lo cual se piensa que existe una
base autoinmunitaria no esclarecida que evita la presencia de adipocitos a ese
nivel.
Factor genético
La
presencia de lupus en familias fue descrita inicialmente a principios del siglo
veinte por Seguira (1903), al observar 2 pares de hermanas que presentaban LEC.
En los años sesenta, Steagall (1962) describe la presencia de LEC en
gemelos, y Burch (1968) observa una mayor incidencia de lesiones discoideas
en parientes de 1º grado, siendo repetida su observación por Lawrence
en 1987 (21).
Los genes
que codifican para interleucina 10 (IL-10) y para el antígeno Ro se ubican
en el brazo largo del cromosoma 1, en el locus 1q31, por lo que las alteraciones
a este nivel se relacionan con el desarrollo de lupus. Se han estudiado numerosos
genes implicados en la respuesta de anticuerpos contra al antígeno Ro,
los cuales se presentan en el cuadro 4 debido a su importancia potencial en
la génesis de la patología lúpica, prestándose especial
interés en los productos para los que codifican.
Grupo |
Gen |
Locus |
Citocinas |
IL-1,
IL-10 |
2q131q31 |
Receptores
de citocinas |
FcγRII,
TCR Cβ1, Cβ2 |
1q237q35 |
Moléculas
de adhesión |
ICAM-1,
E selectina |
19p133p13,
21q23-25 |
Enzimas
antioxidantes |
GST-M1
|
1p13 |
Genes
apoptosis |
Fas |
10q24.1 |
Retrovirus
humanos endógenos |
HRES-1 |
1q42 |
Cuadro
4. Genes asociados con la respuesta contra el antígeno
Ro.
Modificado de: Osmola A, Namysl J, Jagodzinski PP, Prokop J. Genetic
background of cutaneous forms of lupus erythematosus: update on current
evidence. J Appl Genet 2004;45(1):77-86. (21)
|
En el LECA
se ha observado la presencia de HLA-DR2 y HLA-DR3, lo cual permite hablar de
una asociación familiar, junto al hallazgo de la concordancia en gemelos.
La importancia
del componente genético en el LECSA, viene apoyada en la presencia constante
de HLA - B8, DR3, DRW52, DQ2 y DRW6.
En el LECC,
llamado ?polo benigno? del lupus cutáneo, se presentan HLA-B7,
HLA-B8, CW7, DR2, DR3, DQW1 y DQA1, lo cual nos demuestra que la genética
se imbrica en el desarrollo del lupus, principalmente como factor determinante,
pero no suficiente para la génesis de la enfermedad, requiriendo el concurso
de una multifactorialidad para que ocurra la patología.
Es por todo
lo anterior que se hace necesario indagar acerca de la presencia de antecedentes
familiares de lupus cuando nos enfrentamos a un paciente en quien sospechemos
la enfermedad.
Factor
hormonal
En la forma
sistémica del lupus eritematoso, se observa elevación de los niveles
de estrógenos con disminución de la DHEA, testosterona y progesterona.
Se piensa que este hiperestrogenismo sea secundario a la presencia de citocinas
pro inflamatorias (IL6, IL1, TNF-α),
con estimulación de la aromatasa y el subsiguiente aumento en la conversión
de andrógenos a estrógenos (22).
Se ha logrado
relacionar un elevado nivel de estradiol con incremento de la expresión
de CD40 ligando y con activación de linfocitos T en LES (23).
Los elevados
niveles de prolactina se han asociado a actividad de la enfermedad, y se ha
planteado el uso terapéutico de bromocriptina en casos seleccionados
y demostrados (24).
Inmunidad humoral
- Complemento:
Las deficiencias asociadas de factores específicos de la cascada
del complemento, como C1 inhibidor C1Q, C2 y C4, se correlaciona con el
desarrollo de LECC. Si se trata de un déficit conjunto de C2 y C4
se ha relacionado con la génesis de LES y LECSA (25).
Son bien conocidos en la actualidad los déficits de factores del
complemento y su relación porcentual con el desarrollo de LES. La
deficiencia de C1q, C1r, C1s, C4l, esta asociada casi invariablemente a
la aparición de LES; los déficits específicos se asocian
en diversos grados a la enfermedad, a saber, C1q (93%), C4 (75%), C1r y
C1s (57%) y C2 (10%) (26). - Factor
de necrosis tumoral α:
Induce translocación
de los antígenos Ro y La; además de inducir la expresión
de moléculas de adhesión.
- Interferon
γ:
Actúa como inductor
de la apoptosis de queratinocitos.
- Interleucina
1: Citocina con
potente actividad pro inflamatoria. Presenta dos fracciones:
-
IL-1α:
relacionada con los queratinocitos: asociada a alopecia y lesiones focales
inflamatorias.
- IL-1β: relacionada con los monocitos, macrófagos, células
dendríticas.
|