Microbiología
Helicobacter pylori: Un Camino Al Cáncer
Factores que influyen en el desarrollo de la respuesta inmunitaria y participan en la oncogénesis
Antecedentes genéticos
El cáncer gástrico se asocia con el H. pylori y sus factores de patogenicidad; sin embargo, los avances en el estudio del cáncer han demostrado que el hospedero tiene antecedentes predisponentes como la carga y el polimorfismo genético que se va a ver reflejado en la regulación de la respuesta inmunitaria en contra de la bacteria.
Recientemente, el polimorfismo genético del gen de la interleucina -1β (IL-1β) y del gen del antagonista del receptor de la misma (IL-1RN), han sido asociados con el incremento del riesgo a padecer hipoclorhidria y carcinoma gástrico. La IL-1β es una citocina con un potente efecto proinflamatorio que también tiene la capacidad de inhibir poderosamente la secreción de ácido gástrico, y juega un gran papel en el inicio y amplificación de la inflamación, en respuesta a la infección por H. pylori (60). Un alelo polimórfico con una timina (T) en lugar de una citosina (C) en la posición -511 de la región de regulación del gen de la IL-1β (IL-1β -511T) está asociado con un incremento en la producción de IL-1β. Por otro lado, el gen IL-1RN codifica la citocina antagonista del receptor de IL-1β, que se une de manera competitiva a dicho receptor, modulando así los efectos potencialmente dañinos de la IL-1β, por lo que tiene efecto antiinflamatorio. Este gen tiene un número variable de repeticiones en el intrón 2, teniendo así un alelo corto de sólo 2 repeticiones (IL-1RN2) y uno largo de 3 a 6 repeticiones (IL-1RNL). El gen con el alelo polimorfo IL-1RN2 esta asociado con el incremento de la producción de IL-1β (60). La infección por H. pylori en individuos con estos alelos (IL-1β -511T y IL-1RN2) puede tener como resultado un incremento en la producción de IL-1β gástrica, teniendo como consecuencia una inflamación crónica severa, atrofia gástrica, hipoclorhidria y por último puede desencadenar el desarrollo de un carcinoma gástrico (61). Existen muchos otros factores genéticos que favorecen la oncogénesis a nivel gástrico, que son predisponentes exista o no la infección por H. pylori, pero que aunadas a la misma aumentan considerablemente el riesgo a padecer cáncer gástrico; como lo son las mutaciones en el gen de la E-Caderina en familias con cáncer gástrico hereditario de tipo difuso (62). Se estima que 8-10% de los carcinomas gástricos están relacionados a un componente familiar. El cáncer gástrico se ha observado en pacientes con poliposis gastrointestinal como pólipos adenomatoso familiar y Peutz-Jeghers; el incremento de riesgo de cáncer asociado con poliposis adenomatosa ha sido reportado en regiones de alto riesgo como Asia (62).
Respuesta inmune (Reclutamiento de linfocitos)
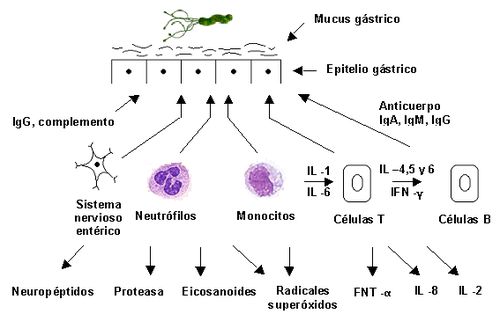
Las células Th1 generan una respuesta inflamatoria y de inmunidad mediada por células por la producción de INF-γ, IL-2, IL-12, IL-18 y TNF-α, una respuesta usualmente eficaz contra microorganismos patógenos intracelulares, mientras que las células Th2 son asociadas preferentemente con la inducción de anticuerpos IgA mediante la producción de IL-4, IL-5, IL-6, IL-10, IL-13 , entre otras citocinas. Siendo H. pylori un microorganismo extracelular, debido a que su hábitat lo constituye la interfase mucosal gástrica, la infección por esta bacteria modifica la diferenciación de las células Th0 hacia una respuesta inmune dominada por una respuesta inflamatoria tipo Th1. Aunque aún no es claro cómo ocurre esta modulación de la respuesta inmune, el proceso inflamatorio y la respuesta inmune celular contribuyen significativamente a la patología gástrica asociada a la infección por H. pylori (27). Sin embargo, esta respuesta con Th1 con altísimos títulos de IgM e IgG (dependiendo del tiempo de la infección), no es protectora y clínicamente es apenas un marcador de enfermedad y no de inmunidad. Por la importancia que tiene actualmente la infección por H. pylori y la afirmación indiscutible de que es el agente etiológico más común de la inflamación gástrica, describiremos los diferentes procesos que ocurren tras su llegada al estómago. La patogénesis de la gastritis crónica por H. pylori incluye dos etapas:
· La primera está caracterizada por la llegada y penetración del microorganismo al mucus gástrico donde se asienta y se multiplica. En esta etapa la bacteria libera varias sustancias tóxicas que son capaces de estimular la respuesta inmunológica local, expresada en un aumento de IgA secretora, con el fin de evitar el proceso de infección. Las principales células inflamatorias participantes en este proceso inicial son los neutrófilos, que son atraídos al sitio de la lesión; de ahí que su presencia en compañía de folículos linfoides se considere como "signo de actividad". Durante esta fase es frecuente observar la invasión de H. pylori en las células epiteliales.
· En la segunda etapa se presenta una amplificación de la respuesta inflamatoria, por la interacción de linfocitos, neutrófilos, macrófagos, células mastoides y células no inmunes que, al ser atraídos al sitio de la lesión, liberan gran variedad de mediadores químicos como: citocinas, eicosanoides, metabolitos reactivos de oxígeno (radicales libres de oxígeno) y el sistema de complemento, que perpetúan la inflamación. En esta última etapa, también participan los neuropéptidos liberados por las neuronas del sistema nervioso entérico, que contribuyen a ampliar la respuesta inflamatoria y aumentan los daños funcionales del estómago colonizado por H. pylori. La segunda etapa es importante en la patogénesis de la inflamación gástrica; resalta la participación del sistema inmune local y sistémico en el control de la infección y la neutralización de las toxinas bacterianas. Además, se potencializa la destrucción hística que, según su intensidad y duración, puede crear una úlcera gastroduodenal.
Grafico Nº 2. Respuesta inmunológica frente a la infección gástrica por H. pylori
Enfermedades de base
Varios metaanálisis han sugerido que la infección crónica por H. pylori induce a un incremento dos o tres veces superior en el riesgo de desarrollar cáncer gástrico. La patogénesis no está clara, pero el incremento en la proliferación celular de las células de la mucosa gástrica asociado con un reflujo biliar crónico parece ser un factor carcinogénico importante. La colonización e infección subsecuente por H. pylori en pacientes sometidos a gastrectomía parcial por enfermedad ulcerosa benigna no parece verse influida por el reflujo biliar, y por tanto, la bacteria podría tener un papel en la carcinogénesis gástrica de los pacientes gastrectomizados (63). Por otro lado, se encuentra la enfermedad de Menetrier, que es una gastropatía de aparición excepcional expresada macroscópicamente como un engrosamiento marcado de pliegues, y microscópicamente con hiperplasia de la superficie mucosa de las células foveolares, con criptas grandes y tortuosas, cuya causa permanece desconocida. En este sentido, se ha descrito recientemente una elevada prevalencia, en un 90 %, de infección por H. pylori en los pacientes que padecen dicha enfermedad, por lo que se ha sugerido que pudiera representar, al menos en un subgrupo de enfermos, una forma especial de gastritis causada por H. pylori (62).
Reinfección
La erradicación de H. pylori cura la úlcera activa y, a largo plazo, da lugar a una drástica reducción de la reaparición de la misma y sus complicaciones (64). Una vez erradicada la bacteria tras un tratamiento efectivo, existen dos tipos de recurrencia de la infección. Un mecanismo sería la recrudescencia, definida como la detección de una cepa de la bacteria similar a la aislada previamente a la erradicación. El otro mecanismo es la verdadera reinfección, esto es, cuando el paciente es infectado por una cepa distinta de H. pylori (65). Para diferenciar recrudescencia de reinfección se requiere la detección de distintas cepas bacterianas, bien mediante la reacción en cadena de la polimerasa (PCR) o el análisis de polimorfismos genéticos (RFLP) (66). Se han propuesto distintos factores como coadyuvantes de la recurrencia de la infección, como la falta de inmunidad natural para la reinfección o el bajo nivel socioeconómico (67). Otros trabajos citan como factores de riesgo la presencia de H. pylori en la placa dental (68), o el reservorio de la infección en el ámbito familiar (69). Otro aspecto motivo de controversia son las implicaciones clínicas de la reinfección por H. pylori. Tras la reinfección pueden ocurrir diversas circunstancias: la reaparición de la infección con o sin síntomas pero sin lesiones, la recidiva ulcerosa con reaparición de la clínica y complicaciones (fundamentalmente con sangrado), y la recidiva de linfoma MALT gástrico, tras haber regresado histológicamente después de la erradicación de la bacteria (70). La recurrencia ulcerosa en pacientes reinfectados oscila en distintas series entre el 3 y el 60%, con un promedio de 20% (71). La mayoría de los trabajos demuestran, además, que la erradicación es más efectiva que el tratamiento con antisecretores de mantenimiento para prevenir recidivas y complicaciones ulcerosas (72). Todos estos aspectos plantean dudas sobre el manejo de los sujetos reinfectados, preguntándose algunos autores si debería seguirse una comprobación periódica y mantenida del estado de infección por H. pylori en estos pacientes y una nueva erradicación cuando estuviera indicado clínicamente, sobre todo, en casos de linfoma MALT o hemorragia ulcerosa (73). La prueba del aliento debería ser la prueba diagnóstica de primera elección para la detección de reinfección, por su nula invasividad y capacidad para explorar toda la cavidad gástrica; pero también puede compararse con otros métodos como la histología o el test de ureasa rápida (74). Se podría proponer en aquellos pacientes erradicados y asintomáticos, especialmente menores de 50 años, el seguimiento mediante prueba de aliento anual, durante los tres primeros años, para detectar una posible reinfección, que se beneficiara de un retratamiento, antes de la aparición de complicaciones. En cambio, en los pacientes erradicados sintomáticos se debería realizar endoscopia digestiva alta diagnóstica. La menor edad de los pacientes y un valor más elevado en el test de aliento posterradicación son factores predictivos de reinfección. Por ello, es recomendable un seguimiento con pruebas de aliento anuales, sobre todo, en menores de 50 años, para la detección de reinfección y así evitar complicaciones ulcerosas ulteriores (75). La tasa de reinfección se sitúa en países subdesarrollados entre el 6,25% en algunas zonas de la población asiática y el 2,4% en ciertas áreas de la población india (76). Por el contrario, la tasa en países desarrollados es inferior al 1% (77).
Factor de crecimiento epitelial
La infección de la mucosa gástrica por H.pylori afecta directamente en el balance normal entre la proliferación celular y la apoptosis, desregulando su ciclo normal, que se presenta con una disminución de la apoptosis en sus primeros estadios (gastritis y atrofias gástricas) y un gran aumento en la proliferación celular en los estadios mas avanzados. Se ha descrito la relación entre la proliferación celular y los cambios genéticos originados en el epitelio gástrico, lo cual está asociado a diversos factores, tales como la liberación de gastrina, factores de crecimiento celular, mutación del gen p53,gen asociado a la apoptosis, que media la activación de una serie de factores relacionados con el aumento de la proliferación celular, como la interleucina 6, factor de crecimiento epitelial (EGF, por sus siglas en idioma inglés), factor de crecimiento similar al de la insulina (IGF, por sus siglas en idioma inglés) y el gen de resistencia a múltiples fármacos (MDR 1, por sus siglas en idioma inglés). Éste desequilibrio en la regulación de los genes que median la apoptosis, pueden evolucionar en última instancia al desarrollo de un tumor. El proceso degenerativo de la mucosa gástrica comienza con la inflamación, conduciendo a la destrucción de las glándulas gástricas, cuando esto ocurre y es reemplazado por otro tejido, se produce una pérdida de glándulas (atrofia), trayendo consigo una reducción en la producción de ácido, característica asociada con el desarrollo de cáncer gástrico. La infección por el H.pylori induce la liberación de radicales del oxigeno, siendo éstos derivados de la activación de neutrófilos, los cuales son factores dañinos de la mucosa gástrica. La protección de las células contra estos radicales del oxigeno (ROS, por sus siglas en idioma inglés), radica en las enzimas secuestradoras de estas especies, como lo son superóxido dismutasa, catalasa y glutatión peroxidasa. La inflamación causada por la infección por H. pylori, produce cambios en la expresión enzimática, como es el caso de las enzimas ciclooxigenasas (COX), que catalizan la conversión de ácido araquidónico a prostanoides como la prostaglandinas, los cuales protegen la mucosa gástrica de la apoptosis, mediante el aumento de la proliferación celular (30). Los factores de crecimiento (FC) son proteínas solubles presentes en el suero imprescindibles para la proliferación celular, por lo que la formación del complejo FC-rFC (factor de crecimiento y su receptor) es un evento importante en la actividad proliferativa. Las mutaciones del complejo FC-rFc producen un estimulo proliferativo constante e independiente de los mecanismos regulatorios, lo que conlleva una hiperproliferación, caraterísticos de los cánceres gástricos (78).
Dieta alta en sal y nitratos
Se ha señalado que la ingesta a largo plazo de elevadas concentraciones de nitratos en alimentos secos, ahumados y salados puede estar relacionada con un mayor riesgo de cáncer gástrico (2). La sal no es un agente carcinógeno, sin embargo, en experimentos de animales tratados con soluciones salinas hipertónicas, se observó un incremento en la proliferación celular en la mucosa gástrica, resultando finalmente en una gastritis atrófica, por lo que puede actuar como agente promotor de la oncogénesis ya que los cambios proliferativos inducidos pueden aumentar los efectos de carcinógenos derivados de alimentos (79). Por ello, se ha postulado que el continuo consumo de altos niveles de sal puede traer como consecuencia una gastritis atrófica que subsecuentemente aumenta el riesgo de cáncer gástrico (79). Los nitratos por su lado actuarían como agentes carcinogenéticos y mutagénicos, a través de la formación, en la mucosa gástrica de nitrosaminas y nitrosamidas (nitritos). La transformación de nitritos a nitratos se produciría por acción reductora de las bacterias. Las nitrosaminas determinarían modificaciones de la mucosa (metaplasia de tipo intestinal, gastritis atrófica), precursoras de la alteración neoplásica (80).
Disminución de vitamina C
Evidencia epidemiológica sugiere una fuerte asociación entre la alta ingesta de ácido ascórbico y la baja incidencia del cáncer gástrico. En estómagos normales la concentración total de vitamina C en el jugo gástrico es cinco veces la del plasma, aparentemente debido a una secreción activa de la mucosa gástrica, existiendo en dos formas principales: ácido ascórbico y ácido dehidroascórbico (forma más activa), el mayor porcentaje esta en la forma reducida. La protección que brinda el ácido ascórbico a la mucosa gástrica es de dos maneras: primero, depurando los radicales libres de oxigeno protegiéndola contra insultos oxidativos, y segundo, inhibiendo la formación de compuestos N-nitrosos por depuración de nitritos libres (81). H. pylori disminuye la cantidad de vitamina C en el jugo gástrico, a través de un mecanismo poco definido, pero se correlaciona con el grado de severidad de infiltración de polimorfonucleares en la mucosa antral, reduce además la proporción de su forma reducida activa; por otro lado se ha visto que en un pH neutro se encuentran reducidos los niveles de ácido ascórbico en el estómago, probablemente debido a que la bacteria produce una depleción del ácido ascórbico por producción de nitritos (82). La gastritis causada por la infección crónica por H. pylori resulta en hipoclorhidria, una condición que permite el crecimiento de diversas bacterias; las bacterias que son reductoras de nitrato pueden convertirlo en nitritos y luego en compuestos nitrosados. La inflamación causada por H. pylori ocasiona producción excesiva de especies reactivas del oxígeno que causan daños en el ADN mediante translocaciones y delecciones (17).
Hipoclorhidria
La hipoclorhidria debida al desarrollo de gastritis atrófica, o en parte funcional, puede favorecer el crecimiento de bacterias en el lumen gástrico; esta sobre población da lugar a altos niveles de nitritos en el lumen del estómago, que al combinarse con aminas y amidas originan compuestos N-nitroso. La saliva deglutida parece ser una fuente de nitratos importante en la generación de estos compuestos. Estos compuestos N-nitroso, o una acción directa del H. pylori (en una infección de largo término) podrían ser responsable de lesiones premalignas, metaplasia intestinal y displasia en la mucosa gástrica. Se ha observado que tanto la infección aguda como la crónica por H. pylori, pueden resultar en hiposecreción ácida marcada (81).
Alcohol
Se ha descrito una relación entre el consumo del alcohol y la infección por el H. pylori, aunque los estudios no han sido concluyentes, se encontró que el consumo de alcohol podría tener un efecto, mas que protector en contra de la infección, de la eliminación de la bacteria. Sin embargo, el estudio también sugiere que el consumo prolongado de bajas cantidades es factor determinante para que este efecto benéfico de eliminación pueda darse, siendo esta ingesta referida preferiblemente a vino tinto (83). Por el contrario, estudios realizados en Moscú arrojan datos totalmente distintos que develan que el consumo de bebidas alcohólicas fuertes, como el vodka, constituye un factor de riesgo elevado en el desarrollo de cáncer gástrico, aunque se observó una mayor tendencia en los hombres a presentar cáncer de cardias en comparación con las mujeres (84). Las diferencias entre los resultados obtenidos en los estudios realizados, en este tópico en particular, podrían basarse en el sesgo de la selección de las personas estudiadas, ya que los investigadores no tomaron los mismos parámetros en el momento de la selección del individuo a estudiar, lo cual es una hipótesis que manejan los autores.
Tabaco
Se ha demostrado mediante metaanálisis que el fumar aumenta el porcentaje de dificultades para el tratamiento de erradicación contra H. pylori (61). Varios factores tales como la resistencia a los antibióticos; la enfermedad del paciente, por ejemplo, úlcera péptica y el consumo de café han influido en la respuesta a la terapia de supresión de H. pylori. Un gran número de estudios han proporcionado evidencia de que el fumar obstaculiza la eliminación de H. pylori; sin embargo, varios artículos no encontraron ninguna asociación (61). Es importante entender los posibles mecanismos detrás de los efectos negativos del tabaquismo en la erradicación de la bacteria. En primer lugar, que fumando el flujo gástrico y la secreción de moco disminuyen y así, puede ser que se reduzca la entrega de antibióticos a la mucosa gástrica. En segundo lugar, el fumar estimula la secreción ácida, que se ha asociado al tratamiento debido a que la amoxicilina es un antibiótico ácido-sensible, y su eficacia puede disminuir en fumadores. En tercer lugar, el fumar puede modular la actividad de las isoenzimas específicas del citocromo p450 implicados en el metabolismo de inhibidores de la bomba de protones. En este sentido, el fumar puede conducir a la progresión de la gastritis atrófica y metaplasia intestinal en los pacientes infectados por H. pylori. Se encontró también que la nicotina tiene la capacidad de reforzar y potenciar la actividad de la toxina VacA de H. pylori en las células gástricas. Los fumadores infectados con H. pylori tienen 11 veces mayor riesgo de cáncer gástrico que los no fumadores no infectados (61).
CONCLUSIONES
Se puede establecer la relación existente entre la neoplasia gástrica y la infección por H. pylori, la cual es la bacteria responsable de la mayoría de los casos de gastroenteritis, úlcera péptica y gastritis crónica.
En los individuos infectados, generalmente están presentes anticuerpos frente al H. pylori, pero no evitan la colonización posterior. Por ello, las personas que adquieren esta bacteria tienden a padecer enfermedades crónicas y asintomáticas por un largo período de tiempo.
Una característica de la infección por este microorganismo en humanos es la gastritis, la cual puede persistir por décadas y evolucionar a cáncer gástrico o linfoma MALT, todo esto aunado a factores dependientes del medio ambiente, del hospedero y de la bacteria per se, tales como sus múltiples determinantes de patogenicidad.
Por último, H. pylori es capaz de interferir en procesos fisiológicos protectores del estómago y duodeno, como la secreción de ácido gástrico, ácido ascórbico, gastrina y somatostatina; así como promover la apoptosis celular y la acumulación de factores que pueden provocar cambios en el genoma de la célula gástrica; todos estos fenómenos predisponen al cáncer gástrico, siendo entonces la erradicación de la bacteria una medida preventiva adecuada. |