Obstetricia
Nutricion de la embarazada, primer pilar de la nutricion para la vida
Infancia: días 270 a 450
Durante e inmediatamente después del
nacimiento, el recién nacido está expuesto a comunidades microbianas complejas
en el entorno externo. Tanto la composición como la función de la microbiota
infantil temprana se definen principalmente por el modo de nacimiento, la
microbiota materna, la exposición a antibióticos y las prácticas de
alimentación en la vida temprana. Dado que la lactancia materna influye
profundamente en el crecimiento del lactante y la sucesión microbiana en las
primeras etapas de la vida, la interacción leche-microbiota puede actuar como
un objetivo principal de intervención a través del cual se podría abordar el
retraso en el crecimiento.
Los primeros 1000 días, el período
desde la concepción hasta los 2 años de edad, representan una ventana crítica
del crecimiento y desarrollo de la primera infancia. Este período prenatal y
postnatal temprano se define por la maduración rápida de las vías metabólicas,
endocrinas, neurales e inmunes, que influyen fuertemente y apoyan el
crecimiento y desarrollo infantil. Estas vías se desarrollan en conjunto y son
altamente interdependientes, con un programa complejo de ensamblaje que depende
de señales internas y externas. Cuando estas vías de desarrollo se ven
desafiadas por agresiones ambientales adversas, como infecciones o una
alimentación subóptima, la trayectoria del crecimiento infantil puede verse
perturbada, que puede manifestarse como sobrenutrición (sobrepeso u obesidad) o
como desnutrición - retraso del crecimiento o desnutrición crónica. 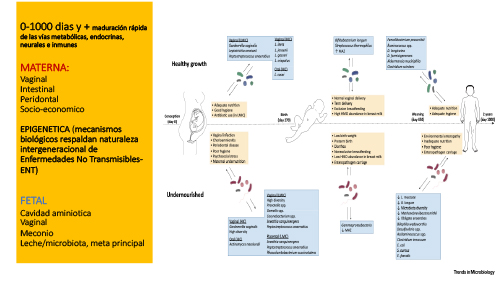
Una perspectiva emergente de la biología del
desarrollo humano incluye los billones de microbios (microbiota) y sus genes
(microbioma) que residen dentro del cuerpo humano, y que se ensamblan y
estabilizan durante los primeros 2 años de vida [5].
La evidencia emergente sugiere que la colonización de
microbios en el cuerpo humano durante la vida temprana juega un papel crítico
en el establecimiento y maduración de vías de desarrollo [6] y que la
interrupción de esta sucesión microbiana óptima puede contribuir a déficits
intergeneracionales y de por vida en el crecimiento y desarrollo
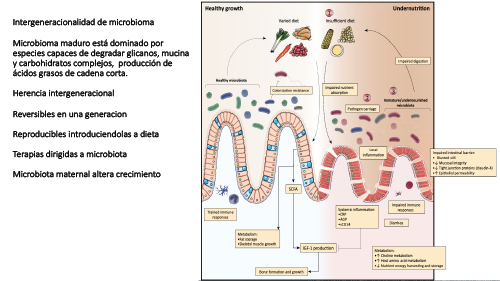
Maduración de la microbiota intestinal sana
La microbiota del recién nacido sano se
asemeja mucho a la microbiota de las heces, la vagina o la piel de la madre,
según el modo de parto. Los primeros colonizadores de la microbiota intestinal
del lactante son típicamente anaerobios facultativos, seguidos de la
acumulación de anaerobios obligados, incluidos Bifidobacterium, Bacteroides y
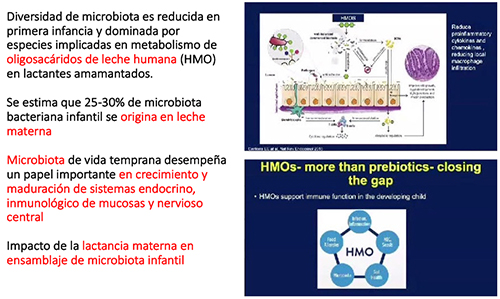
Clostridium durante los siguientes 6 meses [14-16]. La diversidad de la
microbiota sigue siendo reducida en la primera infancia y está dominada por
especies implicadas en el metabolismo de los oligosacáridos de la leche humana
(HMO) en los lactantes amamantados. Se ha estimado que el 25-30% de la
microbiota bacteriana infantil se origina en la leche materna [17]. La sucesión
de la microbiota de la vida temprana desempeña un papel importante en el
crecimiento y la maduración de los sistemas endocrino, inmunológico de las
mucosas y nervioso central [18-19]. Los ratones libres de gérmenes presentan
una reducción significativa de peso y longitud antes del destete en comparación
con los animales criados de forma convencional [20]. Esto puede deberse a
varios factores, incluida la capacidad reducida para obtener energía de la
dieta; sin embargo, también se ha teorizado que las interacciones inducidas por
la microbiota con el factor de crecimiento similar a la insulina 1 (IGF-1), que
permanecen sin caracterizar, también pueden desempeñar un papel en el
crecimiento temprano de la vida.
Leche materna y maduración temprana de la
microbiota intestinal
La sucesión microbiana en los recién nacidos
prematuros parece ser rescatada por la lactancia materna [21], lo que sugiere
un papel esencial de la leche materna en el ensamblaje normal de la microbiota
infantil. Además, el crecimiento también es significativamente mayor en los
lactantes amamantados en comparación con los lactantes prematuros alimentados
con fórmula después del alta hospitalaria [22]. Por lo tanto, se pueden mejorar
las vías de crecimiento y desarrollo. La leche materna alberga una microbiota
diversa, que varía según el peso materno y el modo de parto, y entre las
poblaciones, pero se caracteriza más comúnmente por Proteobacteria
(principalmente Pseudomonas), Staphylococcus y Streptococcus, y tiene una
composición distinta al microbioma cutáneo, oral e intestinal [23, 24].
No se ha investigado la relación entre la microbiota
de la leche materna y el crecimiento infantil; sin embargo, estudios recientes
apoyan el papel esencial de los HMO en la definición de fenotipos de
crecimiento en la vida temprana. Los factores genéticos influyen en la
producción de HMO, por lo que los portadores de un gen activo de la
fucosiltransferasa 2 (FUT2), conocidos como secretores, producen más HMO, tanto
estructuras fucosiladas como sialiladas [25]. Por tanto, el estado de secretores
maternos influye en la composición de la microbiota del lactante, por lo que
Bifidobacterium es más abundante en los lactantes de secretores maternos
[26,27]. El estado de secretor materno per se no se ha asociado con el
crecimiento infantil [28]; sin embargo, los HMO individuales se han asociado
con el crecimiento infantil y la antropometría tanto en entornos de ingresos
altos como bajos [29,30]. En una cohorte de madres e hijos de Gambia, la
30-sialilactosa se asoció positivamente mientras que la sialilacto-N-neotetraosa
se asoció negativamente con la puntuación Z del peso para la edad (WAZ).
Además, la difucosillacto-N-hexaosa a, lacto-N-fucopentaosa I y III se
asociaron positivamente con LAZ.
Charbonneau y col. analizó los mecanismos por
los cuales los HMO interactúan con la microbiota infantil para regular el
crecimiento [21]. Las madres de bebés con retraso en el crecimiento en Malawi
mostraron una abundancia significativamente menor de HMO en la leche materna a
los 6 meses, en particular HMO sialiladas, incluida la sialilacto-N-tetraosa b,
que eran las que discriminaban más el crecimiento. Los fenotipos de
desnutrición se recapitularon en animales colonizando ratones y lechones libres
de gérmenes con un consorcio de organismos cultivados a partir de las heces de
un niño con retraso del crecimiento severo y alimentando a los animales con una
"dieta malauí" subóptima. Sin embargo, complementar a los animales
con oligosacáridos de leche bovina que eran estructuralmente similares a los
HMO promovió el aumento de peso, la masa magra y el volumen óseo en los
animales. Los efectos del crecimiento no se observaron en animales libres de
gérmenes, lo que sugiere un efecto dependiente de la microbiota. Por lo tanto,
las HMO desempeñan un papel único en la formación de la microbiota infantil en
la vida temprana y en la mediación del crecimiento.
|