La inflamación tiene un efecto muy potente sobre la
homeostasis del hierro. En presencia de inflamación, disminuye la absorción
intestinal de hierro, hay un secuestramiento del mismo por el hígado y los
macrófagos, y como consecuencia de esto, se produce una disminución del hierro
circulante que cursa con depósitos de hierro normales o elevados y que eventualmente
termina en la anemia de las enfermedades crónicas, tales como enfermedades
crónicas del riñón, infecciones prolongadas, diabetes, trauma severo, artritis
reumatoidea, enfermedad de Chron y otras enfermedades inflamatorias del aparato
gastrointestinal, cáncer, etc. En general, patologías asociadas con un estímulo
crónico del sistema inmune. Actualmente, es ampliamente aceptado que la anemia
asociada con las enfermedades crónicas es el resultado de una estimulación de
la producción de hepcidina(6,12,21,27). Esto se debe a que el
promotor del gen de la hepcidina (HAMP) no sólo posee elementos de respuesta a oligómeros
SMAD (sensibles al hierro) como ya se discutió, sino también a dímeros STAT
(sensibles a la inflamación) (6,11,12,21).
Experimentos en cultivos de células hepáticas
humanas han mostrado que la IL-6, así como otras interleucinas inflamatorias y
los lipopolisacáridos presentes en las membranas bacterianas, inducen la
expresión de hepcidina. Por otra parte, en voluntarios humanos los niveles de
hepcidina urinaria se incrementaron hasta 7 veces pocas horas después de una
infusión de lipopolisacáridos o de IL-6 (27), señalando que la
hepcidina funciona como un reactante de fase aguda. Esto, está de acuerdo con
las primeras observaciones relacionadas con este péptido al que se le asignó
una función antimicrobiana. Así, antes de conocer su función reguladora del
metabolismo del hierro, a la hepcidina se le conocía como LEAP-1 (Liver
expressed antimicrobial peptide1) (39). En relación con esto, la
visión actual es que la hepcidina funciona como una defensina que ejerce su
actividad antimicrobiana mediante deprivación de hierro, que es un elemento
crítico para la proliferación bacteriana (6). Esto se sustenta en hallazgos
que datan de los años 70 y que indican que las infecciones se vuelven más
severas en condiciones de hiperferremia, la suplementación con hierro en
condiciones de infección aumenta la severidad de la infección y comprometen la
vida del paciente (40,41). Durante la infección y trauma el organismo
tiene mecanismos para secuestrar el hierro en los depósitos y reducir el hierro
sérico (42), disminuyendo así su disponibilidad para los
microorganismos invasores (43). Este efecto es mediado por un
aumento en la síntesis de hepcidina y sus niveles circulantes.
El efecto estimulante de la IL-6, así como el de
otras citoquinas como IL-1, IL-2, IL-7, IL-12, IL-17, IL-23 o mediadores de
inflamación como lipopolisacaridos (LPS), oncostatina, turpentina, etc. sobre
la hepcidina es transcripcional y dependiente de la vía de señalización STAT3
(Fig. 3).
Estos agentes inflamatorios se unen a sus
receptores de membrana y producen la fosforilación de los activadores de
transcripción STAT3. Esta fosforilación esta mediada por la kinasa Janus, JAK2.
La actividad JAK2/STAT3 promueve la dimerización de los activadores STAT3 y su
migración al núcleo celular, donde actúan como factores de transcripción nucleares, que tienen afinidad por la sección
del DNA donde se ubica el gen promotor
de la transcripción de la hepcidina (HAMP) para producir hepcidina (6,11,12,21,27).
Es importante indicar que aunque el efecto de la IL-6 ha sido el más estudiado,
el efecto estimulante de los LPS en la producción de hepcidina se ha detectado
incluso en animales genéticamente modificados para anular la producción de esta
interleuquina. También hay que señalar que la estimulación de la producción de
hepcidina por la vía inflamatoria recién descrita requiere de un sistema
BMP/SMAD intacto, ya que en animales en que este sistema está alterado, no se
produce el aumento en la producción de hepcidina asociado con la inflamación (11,21,45).
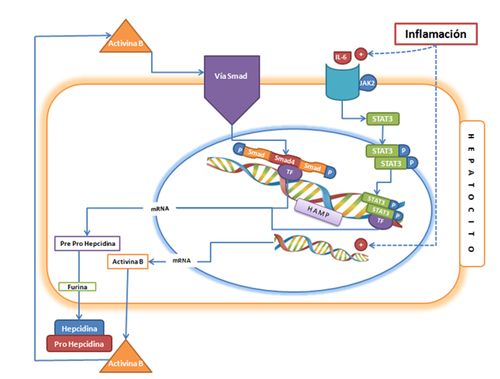
Figura 3. Modelo
de los mecanismos moleculares que participan en la regulación de la expresión de
la hepcidina por la inflamación (6,11,12,21,27,44). Notas: IL-6:
Citoquina proinflamatoria. JAK2:
Tirosina quinasa 2. STAT3: polipéptido
involucrado en la vía de señalización celular STAT capaz de activar el gen HAMP
en respuesta a la inflamación. Activina
B: Proteína multifuncional de la misma familia que BMP6 que se produce en
respuesta a la inflamación. Para más detalles ver Figura 2.
Adicionalmente, se ha demostrado que otros Factores
de Crecimiento Transformantes de la familia TGf-ß, específicamente las Activina
A y B, que usualmente se han asociado con la regulación de los procesos
reproductivos, aumentan su expresión en respuesta a enfermedades inflamatorias
tales como septicemia, enfermedades inflamatorias del tracto gastrointestinal y
artritis reumatoidea (44) y que estimulan la vía SMAD, aumentando la
expresión de la hepcidina. Esto se detectó en el hígado de ratones tratados con
LPS, en los que se observó un incremento en la fosforilación de los SMAD 1/5/8
y producción de precursores de la hepcidina que fue independiente de BMP6 y Fe.
Estas observaciones evidencian un papel no sólo para la vía STAT-3, sino
también de la vía SMAD en la inducción de la producción de hepcidina en
respuesta a la inflamación (44) y explican por qué en condiciones
inflamatorias en que no aumenta la IL-6, puede incrementarse la producción de
hepcidina. Estos conceptos se integran en la Figura 3 que muestra como en un
hepatocito, la inflamación por acción de la IL-6 y su receptor de membrana,
activa la vía de señalización JAK-STAT y al mismo tiempo estimulan la
producción de Activinas, que estimulan la vía de señalización SMAD. Estos estímulos,
actuando por vías de señalización diferentes pueden incrementar la producción de
hepcidina, afectando negativamente la absorción del hierro dietario, así como
la salida del hierro celular (hígado, macrófagos) por la acción de la hepcidina
sobre la ferroportina y DMT1. Con esto se produce un secuestramiento del hierro
con disminución del hierro sérico y eventualmente la anemia secundaria a la
inflamación que caracteriza al enfermo crónico (46).