Biología celular
El receptor del factor de crecimiento epidérmico
La familia de receptores ErbB y sus ligandos
El EGFR es filogenéticamente muy antiguo, ya que existen homólogos de este receptor en diversos invertebrados, como por ejemplo el receptor Let-23 en el gusano nematodo Caenorhabditis elegans (Sternberg et al., 1995), el receptor Der en la mosca de la fruta Drosophila melanogaster (Casci and Freeman, 1999) e incluso se ha descrito un homólogo de este receptor en protozoos parásitos del género Trypanosoma (Hide et al., 1989), aunque la existencia de este último está por confirmar (Borst and Fairlamb, 1998). Además, se han descrito en invertebrados varios ligandos de estos receptores (Muskavitch and Hoffman, 1990; Hill and Sternberg, 1992).
En vertebrados, la familia de receptores ErbB, de la que forma parte el paradigmático EGFR, está constituida además por otros tres receptores análogos identificados hasta la fecha, el ErbB2/HER2/Neu (que tiene una masa molecular de 185 kDa), el ErbB3/HER3 y el ErbB4/HER4 (ambos de 180 kDa) (Alroy and Yarden, 1997; Riese and Stern, 1998). El dominio extracelular de estos receptores está bastante conservado, como ocurre con el dominio proteína quinasa, salvo en el caso de ErbB3 que no posee actividad catalítica, aunque es capaz de unir ATP y transmitir señales mitogénicas mediante su heterodimerización con otros miembros de esta familia de receptores (Soltoff et al., 1994; Guy et al., 1994; Pinkas-Kramarski et al., 1996).
Existe un gran número de ligandos para los receptores ErbB que poseen el llamado módulo semejante a EGF. Así, aparte del propio EGF, tenemos el factor de crecimiento transformante-a (TGF-a, por transforming growth factor-a), la anfirregulina (AR), el factor de crecimiento semejante a EGF que une heparina (HB-EGF, por heparin-binding EGF-like growth factor), la b-celulina (BTC) y la epirregulina (EPR) (Carpenter and Cohen, 1979, 1990; Massagué, 1990; Massagué and Pandiella, 1993; Groenen et al., 1994; Toyoda et al., 1995; Boonstra et al., 1995). Adicionalmente, han sido descritas dos nuevas familias de ligandos de diversos receptores ErbB; estas son las neurregulinas-1 (NRGs-1), también llamadas factores de diferenciación Neu (NDFs, por Neu differentiation factors) o herregulinas, y las llamadas neurregulinas-2 (NRGs-2) (Chang et al., 1997; Carraway et al., 1997; Alroy and Yarden, 1997).
Los diversos ligandos de la familia de receptores ErbB poseen diferentes afinidades de unión a los receptores y cada uno de ellos presenta un patrón de expresión distinto, tanto durante el desarrollo embrionario como en los diversos tejidos del adulto, lo cual contribuye en parte a explicar la pleiotropía funcional de estos receptores. Además, las diversas combinaciones posibles de homodímeros y heterodímeros que forman estos receptores, generan una gran diversificación en la transmisión de señales. Esto es debido en parte a la aparición de baterías diferentes de residuos de tirosina transfosforiladas en los receptores, ya que éstas son específicamente reconocidas por proteínas adaptadoras o transductoras con dominios SH2 y/o dominios PTB diferentes (ver Alroy and Yarden, 1997).
Dentro de la familia de ligandos de los receptores ErbB se distinguen tres grupos funcionales en cuanto a sus capacidades de unir y activar a uno u otro receptor. En el primer grupo estarían incluidos el EGF, el TGF-a y la AR, los cuales son capaces de unir y activar a homodímeros del EGFR y a heterodímeros de éste con otros receptores de esta familia. En un segundo grupo incluiríamos a las NRGs-1 y las NRGs-2, las cuales se unen a homodímeros de ErbB3 o de ErbB4 y a heterodímeros de éstos con otros receptores de esta familia. En el tercer grupo estarían la BTC, la EPR y el HB-EGF, que pueden activar tanto a homodímeros de EGFR o de ErbB4, como a heterodímeros de cada uno de ellos con otros miembros de la familia. El ErbB2/Neu es, sin embargo, un receptor huérfano que carece de ligando directo conocido, aunque es activado por EGF, TGF-a, BTC o NRGs cuando se heterodimeriza con el EGFR o ErbB4 (Alroy and Yarden, 1997; Riese and Stern, 1998).
Una de las características de los ligandos de los receptores ErbB es que son sintetizados como precursores de alto peso molecular que se anclan en la membrana plasmática exponiendo sus módulos semejante a EGF al medio extracelular. Estos precursores son posteriormente procesados proteolíticamente dando lugar a sus formas maduras solubles que son liberadas al medio, siendo así capaces de unirse a receptores de la propia célula que lo sintetiza o de células próximas, dando lugar a activaciones autocrina y paracrina, respectivamente. Sin embargo, es importante resaltar que los precursores unidos a la membrana plasmática pueden ser también funcionales, ya que en ciertos casos son capaces de unirse a receptores ErbB de células adyacentes, por lo que estarían implicados en señalización yuxtacrina (Massagué, 1990; Massagué and Pandiella, 1993) (ver Fig. 2).
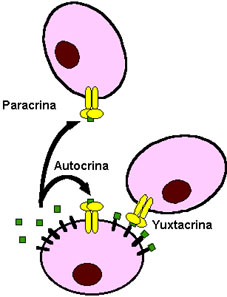
Figura 2. Diferentes modos de acción de los ligandos de receptores ErbB. Los precursores de los ligandos anclados a la membrana plasmática (cuadrados con segmentos) son procesados proteolíticamente generando ligandos maduros (cuadrados). Los ligandos maduros son capaces de interaccionar con receptores ErbB (dímeros en forma de T) localizados en la misma célula (activación autocrina) o en células próximas (activación paracrina), mientras que los precursores unidos a la membrana plasmática pueden interaccionar con receptores localizados en células adyacentes (activación yuxtacrina). Para más detalles ver texto.

El EGF fue el primer factor de crecimiento que se describió hace ya casi cuatro décadas. Éste es un polipéptido no glicosilado de 53 aminoácidos que puede aislarse en grandes cantidades de glándulas salivares submaxilares hipertróficas del ratón. El EGF se encuentra también en muchos fluidos biológicos, especialmente en la leche y en la orina de hembras gestantes (ver Carpenter and Cohen, 1979, 1990; Boonstra et al., 1995). En humanos, el gen que lo codifica se encuentra localizado en el cromosoma 4. Este gen está constituido por 24 exones separados por grandes regiones no codificantes, siendo su transcrito primario de aproximadamente 110 kb. Este transcrito es procesado posteriormente dando lugar a un ARNm de 4,8 kb que es traslocado fuera del núcleo y codifica a un precursor de más de 1200 aminoácidos, el preproEGF. El precursor contiene una región hidrofóbica que le permite atravesar la membrana plasmática y nueve módulos extracelulares semejantes a EGF. El procesamiento proteolítico secuencial de este precursor da lugar a la formación del EGF maduro (Gray et al., 1983; Rall et al., 1985; Bell et al., 1986; Massagué and Pandiella, 1993; Boonstra et al., 1995). La cadena polipeptídica del EGF mantiene su estructura terciaria fundamentalmente mediante tres enlaces disulfuro. Estos enlaces, que son esenciales para su actividad biológica, se encuentran conservados en otros polipéptidos de esta familia de factores de crecimiento (Taylor et al., 1972; Boonstra et al., 1995).
El TGF-a es un potente factor mitogénico, e importante ligando del EGFR, que está constituido por una cadena polipeptídica de 50 aminoácidos y se genera por procesamiento proteolítico de un precursor anclado a la membrana plasmática de 160 aminoácidos. Este factor de crecimiento parece tener un papel predominante tanto en embriogénesis como en angiogénesis, sobreexpresándose además en muchos tumores de origen ectodérmico (Massagué, 1990; Massagué and Pandiella, 1993).
Otros ligandos fisiológicos del EGFR como la AR y el HB-EGF, así como el factor de crecimiento derivado del virus de la vacinia (VGF, por vaccinia virus growth factor), codificado por este virus y que se expresa en células infectadas por el mismo, también se sintetizan como precursores anclados a la membrana plasmática que contienen módulos extracelulares semejante a EGF. Estos precursores son también procesados proteolíticamente para dar sus formas solubles (Massagué and Pandiella, 1993).
Las NRGs-1 se expresan predominantemente en órganos parenquimales y en el sistema nervioso central y periférico del embrión. Las diferentes isoformas de NRGs-1 son productos del procesamiento alternativo de un solo gen y son también sintetizadas como precursores transmembranales que son posteriormente proteolizados generando sus formas maduras. Estos precursores presentan en el dominio extracelular un módulo semejante a EGF y otros dominios que varían en las diversas isoformas (Peles and Yarden, 1993; Carraway and Burden, 1995, Alroy and Yarden, 1997). El gen de la NRG-2 da lugar, por procesamiento alternativo del módulo semejante a EGF, a dos isoformas: la NRG-2a y la NRG-2b. Se ha demostrado que las NRGs-2 se expresan de forma mayoritaria en el cerebelo, siendo su patrón de expresión diferente al de las NRGs-1. Además, las familias de las NRGs-1 y NRGs-2 median respuestas fisiológicas distintas en las células donde actúan (Carraway et al., 1997), siendo la NRG-2b particularmente activa en aquellas células que expresan ErbB3 y/o ErbB4 (Chang et al., 1997). |