Biología celular
El receptor del factor de crecimiento epidérmico
Transactivación de receptores ErbB por otras familias de receptores
Una de las características de las vías de transducción de señales de la célula, es que éstas están interconectadas y forman complejos entramados que juegan un papel muy importante en la plasticidad de la respuesta celular. Así, la redundancia y cooperatividad de estas vías son elementos evolutivos utilizados por la célula para asegurar su supervivencia, disminuyendo la posibilidad de daños irreparables en vías esenciales de señalización. Además, estas interconexiones generan respuestas celulares más complejas y adaptables a las diversas condiciones fisiológicas. Así, no es de extrañar que recientemente se hayan puesto en evidencia conexiones mutuas entre señales provenientes de receptores ErbB y receptores pertenecientes a otras familias no relacionadas. En esta sección mencionaremos algunas de estas comunicaciones cruzadas.
De gran interés es el hecho de que el EGFR pueda interaccionar con otros receptores que poseen actividad tirosina quinasa intrínseca pero que no pertenecen a la familia de receptores ErbB. Así, se ha demostrado que el EGFR fosforila al PDGFR-b (por platelet-derived growth factor receptor-b), lo que resulta en el reclutamiento de la PI3K por este último y la activación de esta vía de señalización en ausencia del ligando del PDGFR (Habib et al., 1998) (ver Fig. 12).
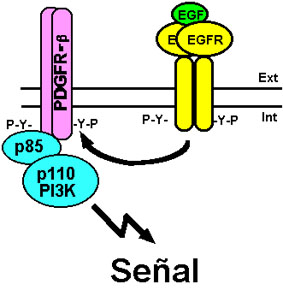
Figura 12. Transactivación del receptor de PDGF por el EGFR. El EGFR fosforila al PDGFR-b y éste es capaz de reclutar a la PI3K, generando así señales en ausencia del ligando PDGF. Para más detalles ver texto.

Dentro del amplio grupo de receptores para las diversas citoquinas, se han detectado algunos que parecen estar implicados en la transactivación del EGFR y otros receptores ErbB. Entre los receptores que transactivan el EGFR tenemos el receptor de TNF (por tumor necrosis factor) (Donato et al., 1989, 1992), y el receptor de la hormona de crecimiento, proceso mediado por la tirosina quinasa Jak2 (por Janus kinase 2) (Yamauchi et al., 1997) (ver Fig. 13). Por otro lado, el TNF-a y el TNF-b inducen un aumento de la expresión del EGFR y una disminución en la expresión del receptor ErbB2/Neu (Kalthoff et al., 1993). Además, la subunidad b del receptor del factor de crecimiento de granulocitos y macrófagos y estimulador de la formación de colonias (GM-CSF, por granulocyte/macrophage-colony stimulating factor) parece interaccionar con el EGFR (García-Manero et al., 1998), mientras que el receptor de la interleuquina-6 transactiva al heterodímero ErbB2/ErbB3, pero no al EGFR (Qiu et al., 1998).
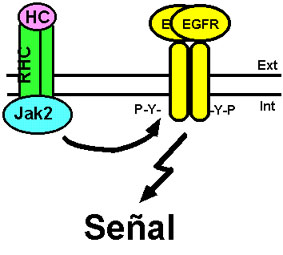
Figura 13. Transactivación del EGFR por el receptor de la hormona del crecimiento. La activación del receptor de la hormona del crecimiento (RHC) por su ligando (HC) induce la transactivación del EGFR en ausencia de EGF por un mecanismo en el que está envuelta la tirosina quinasa Jak2. Para más detalles ver texto.

Uno de los hallazgos más interesantes en este campo ha sido la demostración de que el EGFR puede ser también transactivado por diferentes miembros de la numerosísima familia de receptores acoplados a proteínas G heterotriméricas (GPCRs, por G protein-coupled receptors), como son los receptores de ácido lisofosfatídico, de adrenalina, de acetilcolina, de endotelina 1, de trombina y de ATP extracelular (Daub et al., 1996, 1997; Tsai et al., 1997; Luttrell et al., 1997; Soltoff, 1998). Así, en fibroblastos de rata, se ha observado tras la estimulación de las células con ácido lisofosfatídico, endotelina 1 o trombina, una rápida fosforilación del EGFR y del receptor ErbB2/Neu, así como la activación de la vía de las MAPKs. Esta activación y la síntesis de ADN se suprimen en gran medida cuando las células son tratadas con inhibidores específicos del EGFR, lo cual sugiere que éste está implicado en la activación de la vía de la MAPK mediada por agonistas de los GPCRs (Daub et al., 1996). En ciertos casos, estos procesos están mediados por el dímero formado por la subunidad bg (Gbg) de las proteínas G heterotriméricas, que es liberado tras la activación de los GPCRs. Gbg activa a Src y esta tirosina quinasa fosforila al EGFR quién induce el reclutamiento de la proteína adaptadora Shc, la cual a su vez se une al complejo Grb2/Sos activando así la vía Ras/MAPK (Luttrell et al., 1997) (ver Fig. 14). La transactivación del EGFR por GPCRs ha sido también observada en otros tipos celulares como son queratinocitos, astrocitos y células COS-7. En estas últimas, la inhibición de la PI3K no afecta a la fosforilación del EGFR mediada por el GPCR, pero sí se inhibe la estimulación de la vía de la MAPK (Daub et al., 1997). Otros autores han descrito la dimerización y activación del EGFR inducida por el receptor m1 muscarínico de la acetilcolina en un proceso independiente de EGF en el que interviene la PKC (Tsai et al., 1997). Las vías que conectan los GPCRs con el EGFR no están aún bien definidas, y es posible que sean más complejas de lo esperado, ya que en la región citosólica yuxtamembranal del EGFR existe una secuencia de reconocimiento e interacción con la subunidad a de la proteína Gs (Sun et al., 1997).
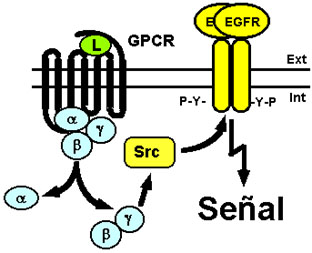
Figura 14. Transactivación del EGFR por receptores acoplados a proteínas G. La activación del GPCR por su ligando (L) induce la transactivación del EGFR en ausencia de EGF por un mecanismo en el que está implicada la tirosina quinasa Src que es activada por el dímero bg de la proteína G heterotrimérica que se libera en el proceso. Para más detalles ver texto.
|