Biología celular
El receptor del factor de crecimiento epidérmico
Implicación de receptores ErbB en carcinogénesis
La implicación del EGFR en la proliferación incontrolada de ciertas células tumorales se dedujo a partir de tres hechos fundamentales. Por un lado, el oncogén v-erbB de origen vírico codifica una proteína truncada homóloga del EGFR que presenta una actividad tirosina quinasa hiperactiva (ver Carpenter, 1987); por otro lado, la sobreexpresión del EGFR en fibroblastos induce la aparición de un fenotipo transformado dependiente de la presencia del ligando (Di Fiore et al., 1987); y finalmente, es frecuente observar la sobreexpresión del EGFR, con o sin la amplificación de su gen, en varios tipos de tumores humanos y líneas celulares tumorales (Merlino et al., 1984; Ullrich et al., 1984; Ekstrand et al., 1994; Nishikawa et al., 1994). La presencia de un número excesivamente alto de copias de EGFR en la célula provoca un aumento de la sensibilidad a sus ligandos que, incluso a concentraciones muy bajas, son capaces de estimular las células e inducir proliferación celular. Por otro lado, el proceso de internalización de los receptores en estas circunstancias es más lento porque se excede la capacidad de endocitosis de la célula, por lo que éstas no pueden reprimir adecuadamente la transmisión de las señales mitogénicas que se generan de una forma continuada (Cadena and Gill, 1992) (ver Fig. 16).
También es frecuente en una gran variedad de tumores la coexpresión aumentada de los receptores homólogos ErbB2/Neu y ErbB3, así como mutaciones del receptor ErbB2/Neu que dan lugar a la formación de puentes disulfuro anómalos entre receptores contiguos y a la consecuente dimerización constitutiva de los mismos (Kim and Muller, 1999). La sobreexpresión del EGFR y el receptor ErbB2/Neu es muy frecuente en adenocarcinomas y contribuye al desarrollo y mantenimiento del fenotipo celular maligno. En clínica, la coexistencia de ambos receptores se relaciona con un peor pronóstico de la evolución de la enfermedad (Kalthoff et al., 1993). La presencia de un gran número de receptores ErbB2 suele ir además asociada a una pérdida de la función de los receptores de estrógenos, lo que explicaría la baja respuesta a las terapias basadas en el uso de antagonistas de estrógenos en estos pacientes (Kim and Muller, 1999).
Además de la sobreexpresión del EGFR en muchos tumores, en otros es frecuente observar la coexistencia del receptor normal con receptores aberrantes truncados. En la mayoría de las ocasiones, los tumores presentan deleciones de exones que codifican parte del dominio extracelular del receptor (ver Fig. 16). Así, el EGFRvI es un receptor mutado similar al producto del oncogén v-erbB1, que está constitutivamente activado (Haley et al., 1989; Wong et al., 1992). Por otro lado, el receptor mutado EGFRvII tiene una deleción de 83 aminoácidos de su región extracelular. Este receptor mantiene la capacidad de unir el ligando pero presenta un aumento de su actividad tirosina quinasa (Humphrey et al., 1991). Por el contrario, el receptor mutado EGFRvIII tiene una masa molecular de 140 kDa ya que carece de la parte del dominio extracelular codificada por los exones 2-7 y no posee un sitio de unión del ligando completo. Esta mutación también provoca un cambio conformacional en el receptor que estimula la actividad tirosina quinasa y aumenta la capacidad tumorogénica de las células que lo expresan (Ekstrand et al, 1994; Nishikawa et al., 1994). Menos frecuentes son las mutaciones que dan lugar a receptores truncados en su extremo C-terminal, lo que puede afectar al dominio tirosina quinasa. Estos receptores truncados se han descrito en algunos sarcomas (Yamamoto et al., 1983; Pelley et al., 1989) y en células de carcinoma epidermoide (Ullrich et al., 1984) (ver Fig. 16).
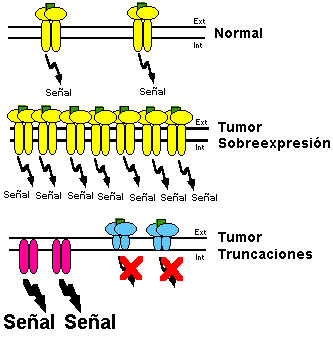
Figura 16. Alteraciones del EGFR en células tumorales. En células normales (panel superior) se expresa un número moderado (por ejemplo 53-103 copias por célula) del EGFR (dímeros en forma de T) que señalizan adecuadamente. En ciertas células tumorales el EGFR puede sobreexpresarse (por ejemplo 4003 receptores por célula) generando un alto nivel de señalización (panel central). Otros tumores expresan formas truncadas aberrantes del EGFR que carecen del dominio extracelular, presentando una actividad tirosina quinasa hiperactiva que señaliza en ausencia del control ejercido por el ligando (panel inferior, izquierda), o formas truncadas que carecen del dominio intracelular y no tienen actividad tirosina quinasa y por lo tanto no señalizan directamente, aunque son capaces de unir el ligando (panel inferior, derecha).

Otras formas anómalas del EGFR poseen duplicaciones de algunos dominios funcionales. Así, en células de glioma humano se ha descrito la presencia de un EGFR aberrante de 190-200 kDa que presenta dos copias del dominio responsable de la actividad catalítica tirosina quinasa (dominio TK, por tyrosine kinase domain) y del dominio denominado CAIN (por Ca2+/internalization domain), que está implicado en la generación de la señal del calcio y la internalización del receptor. Esta mutación es consecuencia de la duplicación de los exones 18-26 en el transcrito del EGFR. Ambos dominios tirosina quinasa son funcionales, pero el dominio denominado TK-1 no puede ser regulado adecuadamente porque se encuentra alejado por un segmento de 367 aminoácidos de su dominio regulador, y el dominio denominado TK-2 presenta una mutación puntual que también altera su actividad tirosina quinasa (Fenstermaker et al., 1998).
La identificación y caracterización de mutaciones en los receptores ErbB y el estudio de los mecanismos de señalización y regulación de estos receptores es de interés no sólo para el conocimiento de los sistemas de activación y control de la proliferación celular mediada por mitógenos, sino para comprender ciertos mecanismos responsables de la transformación oncogénica de la célula. Por lo tanto, estos estudios pueden abrir nuevas vías para el desarrollo de métodos adecuados para el diagnóstico precoz de los tumores y la predicción de la evolución de la enfermedad, así como para el desarrollo de metodologías de terapia génica para la intervención de estos pacientes. |