Biología celular
El receptor del factor de crecimiento epidérmico
Internalización de EGFR
Además de los mecanismos que regulan de forma rápida la actividad tirosina quinasa del EGFR, mencionados anteriormente, existen otros mecanismos de desensibilización lenta del receptor que implican la internalización y la degradación proteolítica del mismo. Así, una vez que el receptor ha transmitido las correspondientes señales, el complejo ligando-receptor es internalizado hacia los endosomas primarios, principalmente mediante su inclusión en vesículas recubiertas de clatrina, aunque parecen existir otras vías independientes de éstas. El destino último del receptor internalizado puede ser su degradación proteolítica en lisosomas o su retorno a la membrana plasmática (Trowbridge et al., 1993; Mellman, 1996; Waterman et al., 1998; Sorkina et al., 1999) (ver Fig. 15). Esto depende en parte del tipo de ligando unido al receptor. De esta forma, los receptores ErbB activados por EGF son dirigidos en su mayoría a la degradación lisosomal, mientras que los receptores activados por NDF o TGF-a son reciclados de vuelta a la superficie celular (Waterman et al., 1998).
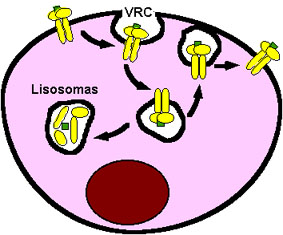
Figura 15. Procesamiento y reciclaje del EGFR. El EGFR (dímeros en forma de T) es internalizado por endocitosis en vesículas recubiertas de clatrina (VRC). El destino del receptor puede ser su degradación proteolítica en los lisosomas o su reciclaje y vuelta a la membrana plasmática. Para más detalles ver texto.

La internalización del EGFR mediada por vesículas recubiertas de clatrina es un proceso complejo en el que intervienen las proteínas adaptadoras AP-1 y AP-2 (por adaptor proteins 1 y 2) y la proteína Eps15 (por epidermal growth factor pathway substrate 15) que juega un papel estabilizador en dicho proceso (Sorkina et al., 1999; Torrisi et al., 1999). Además, durante la internalización del EGFR se produce la ubiquitinación del mismo (Galcheva-Gargova et al., 1995). En este proceso parece estar implicada la proteína c-Cbl que es fosforilada en residuos de tirosina tras la activación del receptor y aparece en los endosomas en los que se internaliza el mismo (Levkowitz et al., 1998; Ettenberg et al., 1999; Waterman et al., 1999). La unión de la proteína c-Cbl a la región carboxilo terminal del receptor depende de la actividad tirosina quinasa de éste. Además, se ha demostrado que la internalización y degradación del EGFR se ve afectada cuando se producen mutaciones en las tirosinas transfosforilables, lo cual demuestra la importancia de estos residuos en el procesamiento del receptor (Emlet et al., 1997). También se ha descrito un dominio específico en la región citosólica del receptor implicado en su internalización, y la importancia de la presencia de cargas negativas cercanas a la Tyr992 del receptor en este proceso (Holbrook et al., 1999).
La internalización del EGFR aminora la señal mitogénica, jugando así un papel relevante en la prevención de la proliferación celular incontrolada. De hecho, en las células en las que existen mutaciones en los genes que codifican las proteínas implicadas en la internalización de los receptores ErbB se observa un aumento de la proliferación celular y su transformación en fenotipos malignos. |