Microbiología
Manifestaciones extragástricas de la respuesta inmunitaria frente a la infección gástrica por Helicobacter pylori
Modelo teórico de H. pylori como inductor de la respuesta inmunitaria en la UCI
Como se ha mencionado hasta ahora, existen muchas hipótesis patogénicas que han tratado de explicar la acción lesiva a distancia del H. pylori sobre la piel, pero para efectos de este trabajo se ha considerado tomar como modelo principal el mecanismo basado en la alteración de la barrera gastrointestinal causada por este patógeno, con la consiguiente penetración de alergenos alimentarios, lo cual ha sido ya propuesto en varias investigaciones (20). No por ello se menosprecian los aportes que pueden realizar otras concepciones antes descritas, ya que es menester recordar la multifactorialidad de la patogénesis de la UCI, más aún al considerar la importancia del componente alérgico en los orígenes de la misma.
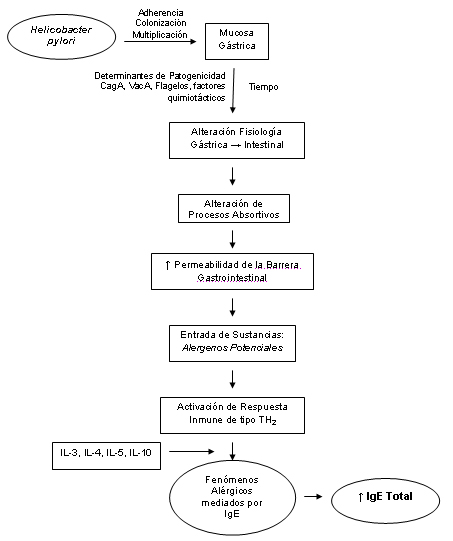
El modelo a proponer plantea lo siguiente: H. pylori se adhiere a las células secretoras de moco de la mucosa gástrica, a través de ligandos y receptores específicos (adhesinas), unos potentes flagelos le permiten desplazarse con facilidad en esta capa y hacer contacto con las células epiteliales. Este proceso se puede catalogar como íactivo? puesto que esta mediado por adhesinas específicas, que permiten la fijación de la bacteria e impiden que la misma sea arrastrada por el peristaltismo, la actividad ciliar y el recambio epitelial (3, 28), allí ocurren las primeras etapas de la infección (adherencia, colonización y multiplicación).
Luego del establecimiento del patógeno en la mucosa gástrica, aumenta la contigüidad con la célula epitelial, lo cual le permite transferir alguna de sus citotoxinas y enzimas que no sólo le ayudan en su resistencia al medio externo, sino que llevan a cabo la alteración fisiológica de la mucosa gastrointestinal.
Tal es el caso de la proteína CagA, cuya acción es potenciar la capacidad citotóxica e incrementa el riesgo de que la infección esté asociada a formas agresivas de enfermedad, aunque es necesario hacer notar que a pesar de esto la respuesta terapéutica es muy buena si se emplea una adecuada terapia de erradicación (3, 28).
La otra proteína de importancia es VacA, por los daños vacuolizantes que causa a nivel celular; además de otras proteínas con actividad quimiotáctica específica sobre neutrófilos (proteína quimiotáctica de neutrófilos) y con actividad estimulante proinflamatoria (28, 50).
A partir de que un individuo es infectado por H. pylori, éste puede persistir en el estómago por décadas e impulsar la respuesta del sistema inmune que produce una reacción principalmente inflamatoria. La incapacidad de esta respuesta del huésped para lograr la erradicación de la bacteria no previene la instalación de una respuesta inflamatoria como parte de la reacción del huésped hacia el daño de parte o todo el tejido por algún agente externo (50-52).
El primer mecanismo de defensa, tras el contacto de H. pylori con células epiteliales, está representado por la inmunidad innata, a través de la cual se induce la secreción de IL-8 por parte de estas células, esta citocina es un potente agente quimiotáctico que estimula la desgranulación de granulocitos y causa daño en la capa mucosa (1, 50, 52).
En la mucosa gástrica la respuesta inmune adaptativa frente a la infección por H. pylori es la inmunidad celular específica para el antígeno. Ésta es mediada por linfocitos TH1 cuya diferenciación se debe a la presencia de IL-12 (en la mucosa infectada se observan altos niveles de RNAm para INFγ e IL-12, que evidencian este hecho, además no hay IL-4 que es supresora de dicha diferenciación) (1, 23, 50, 52).
Los linfocitos TH1 producen varias citocinas como IFNγ, que incrementa la expresión de las moléculas CMH clase II en los sitios de inflamación y TNFa, que tiene actividad proinflamatoria y es mediador del daño tisular e inflamación de la mucosa gástrica. Cuando estas células son estimuladas por antígenos o mitógenos liberan también IL-2, pero esta no parece estar vinculada a la reacción, ya que se han encontrado niveles casi nulos de esta citocina en la mucosa gástrica infectada por H. pylori (1, 23,50, 52).
Lo anterior induce alteraciones de los procesos absortivos, traducidos en el aumento de la permeabilidad de la barrera gastrointestinal, celular y vascular. De esta manera se permite la entrada de sustancias que no causaban estimulación inmunológica importante por encontrarse limitado su acceso, aunque son conocidos como alergizantes (íalergenos potenciales?) y que ahora actúan como íalergenos reales? (20).
A partir de allí se desencadenan respuestas inmunitarias de tipo TH2 en las que predominan fenómenos alérgicos mediados por IgE, estimulados por el aumento de citocinas como IL4 e IL-10, que incitan la proliferación de monocitos y la activación de los mismos conjuntamente con los macrófagos, así como también de las células B para la producción de IgG e IgE. Además está implicada en la inmunorregulación de la producción de citocinas proinflamatorias tales como IL-1β y TNFa La IL-5, que de igual forma interviene en esta respuesta es producida por TH2 y activa eosinófilos. De esta manera se desarrollan reacciones de hipersensibilidad inmediata tipo I, en los cuales se elevan aún más los títulos de IgE en el suero de pacientes previamente atópicos (1, 22, 23).
De acuerdo al carácter multifactorial al cual puede deberse el aumento de IgE total, que es observado a través de la no variación del mismo luego de intervención terapéutica (situación que también es observada para niveles de IgE anti-H. pylori), se deduce que el papel del H. pylori corresponde al de un intermediario para que alergenos alimentarios (que fisiológicamente no inducen respuestas inmunitarias), puedan activar respuestas alérgicas debido a una mayor penetración al organismo, más aún en el paciente previamente atópico, provocando la respuesta característica de la UCI (20) (Gráfico 7).
|
Gráfico 7. Modelo teórico propuesto para la génesis de la UCI asociada a la infección gástrica por H. pylori |
|
| |